Questões de Concurso
Foram encontradas 8.712 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I. os eletrodos estejam conectados externamente, através de um condutor metálico. II. as duas soluções de eletrólitos estejam em contato, permitindo o movimento de íons entre elas. III. uma reação de transferência de elétrons possa ocorrer em cada um dos eletrodos.
São CORRETAS as afirmativas:
A concentração de NaCl é, em mol/L,
4 análises são realizadas ao mesmo tempo, nas mesmas condições e com a mesma concentração de Ag+ .
Dado:
Composto / Kps Agl / 8,3 x 10-17 AgBr / 5,2 x 10-13 AgCl / 1,8 x 10-10 AgIO3 / 3 x 10-8
Se as análises envolverem os íons I- , Br- , Cl- e IO3 - qual deles precipitará primeiro?
Um laboratorista construiu o seguinte gráfico durante uma titulação ácido-base.
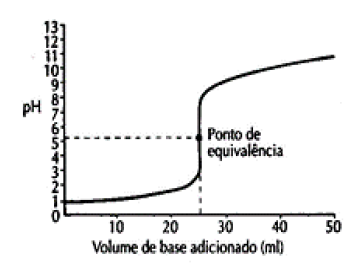
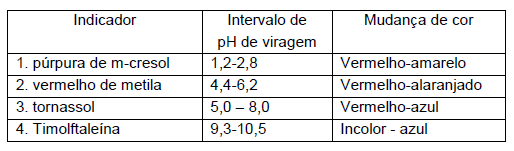
Dos 4 indicadores, qual seria o mais adequado para determinar o ponto de equivalência?
A precisão do método é criticamente dependente das propriedades desse composto.
Padrão secundário: substância que tem sua concentração determinada por análise química e é utilizada como referência em análises volumétricas.
O NaOH é um sólido muito higroscópico (absorve umidade do ar), além de reagir com o dióxido de carbono do ar, sendo transformado em carbonato de sódio e água, conforme a equação:
2 NaOH + CO2 Na2-->CO3 + H2O
Com base nessas informações, o hidróxido de sódio é um
É muito comum encontramos álcool no mercado com a indicação: 77oGL.
Gay Lussac (°GL = %V): quantidade em mililitros de álcool absoluto contida em 100 mililitros de mistura hidro-alcoólica.
É comum também, ao lado da concentração em v/v da solução hidro-alcoólica, encontrarmos a indicação INPM.
INPM (%P = porcentagem de álcool em peso ou grau alcoólico INPM): quantidade em gramas de álcool absoluto contida em 100 gramas de mistura hidro-alcoólica. Se quisermos converter 77oGL em INPM, encontraremos o valor:
Dado: densidade do álcool = 0,8 g.cm-3 e da água = 1,0 g.cm-3
Considere as figuras abaixo:

A figura
Para uma molécula polimérica linear, o comprimento total da cadeia L depende do comprimento da ligação entre os átomos da cadeia d, do número de ligações na molécula N e do ângulo entre átomos adjacentes na cadeia principal θ , de acordo com:
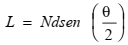
Adicionalmente, a distância média de uma extremidade à outra para uma série de moléculas polimérica r, é igual a:
r = d√N
Determine, para um polietileno linear (2 átomos de carbono (12,01 uma) e 4 átomos de hidrogênio (1,08 uma)) o peso molecular médio para um comprimento total da cadeia de 2 500 nm e uma distância média de 20 nm.
Dado: sen(109/2) = 0,81
A função orgânica oxigenada, que é caracterizada por um átomo de oxigênio unido por ligações simples a um átomo de hidrogênio e a um átomo de carbono de anel benzênico, é a(o)
Na mistura, a pressão parcial, em atm, do CO2 é
C3 H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2 O (g); ∆Ho = -490 kJ mol-1
A queima de uma quantidade de propano produziu 98.000 kJ de calor.
Conclui-se que a massa, em gramas, de propano que reagiu foi
Dado M (C3 H8 ) = 44 g mol-1
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
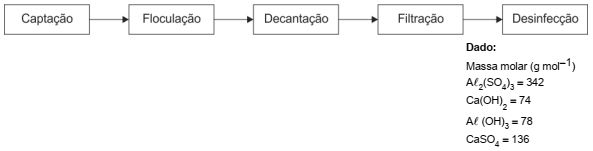
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
Considere uma solução aquosa 0,1 mol L−1 contendo os cátions Sr2+, Ca2+, Ba2+, Ra2+ e Pb2+.
Dadas as constantes do produto de solubilidade (KPS):
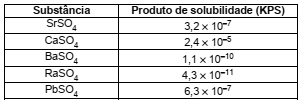
Se íons sulfato (SO2-4) forem gradualmente adicionados à solução acima,
O rompimento de uma adutora de 700 mm de diâmetro na tarde de quinta-feira do dia 22 de março de 2018, localizada no quilômetro 59 da via marginal da Anhanguera, afetou o abastecimento de água em alguns bairros de Jundiaí (SP).
(Adaptado de: https://g1.globo.com)
Esse evento pode ocorrer devido à corrosão eletroquímica. Em tubulações de ferro é adequado fazer proteção catódica, utilizando ânodos fixados na tubulação que fica submersa no solo.
Considere os seguintes potenciais de redução, a 25,0 °C:
Fe2+(aq) + 2 e− ⇋ Fe(s) Eo = −0,440 V
Cu2+ (aq) + 2 e− ⇋ Cu(s) Eo = +0,337 V
Sn2+ (aq) + 2 e− ⇋ Sn(s) Eo = −0,136 V
Ni2+ (aq) + 2 e− ⇋ Ni(s) Eo = −0,250 V
Co2+ (aq) + 2 e− ⇋ Co(s) Eo = −0,277 V
Zn2+ (aq) + 2 e− ⇋ Zn(s) Eo = −0,763 V
O metal mais apropriado como ânodo é o
Oxirredução é um processo em que ocorre transferência de elétrons entre as espécies no decorrer de uma reação química.
K2Cr2O7 (aq) + 4 H2SO4 (aq) + 3 C2H5OH (aq) → 3 C2H4O (g) + K2SO4 (aq) + Cr2 (SO4)3 (aq) + 7 H2O (l)
Considerando a reação entre dicromato de potássio (K2Cr2O7) com álcool etílico (C2H5OH) na presença de ácido sulfúrico
(H2SO4),