Questões de Concurso Comentadas para sme - sp
Foram encontradas 653 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere as reações de P4O10 incompletas e não balanceadas:
I. P4O10 + a KOH → b K3PO4 + c H2O II. P4O10 + d HClO4 → e X + f H3PO4
A esse respeito, é correto afirmar que
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
A Cipermetrina é uma substância do grupo dos piretróides e possui classificação toxicológica nível II (altamente tóxica). É fotoestável, não se degradando com a luz solar. Atua como um potente inseticida, por contato ou ingestão, contra alvos biológicos que causam consideráveis danos a culturas como algodão, café, milho e soja.
A fórmula que representa a estrutura química da cipermetrina é mostrada a seguir.
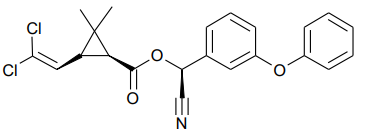
Nessa estrutura, é possível identificar os grupos funcionais
Entretanto, observa-se que, contrário à regra, os valores daprimeira energia de ionização dos átomos nitrogênio (Z = 7) eoxigênio (Z = 8) mostram EI(O) < EI(N):
• EI(N) = 1402 kJ mol-1 • EI(O) = 1314 kJ mol-1
Assinale a opção que justifica corretamente a relação entre osvalores de EI do nitrogênio e do oxigênio.
1. A quantização do momento angular. 2. O equilíbrio mecânico atingido pela igualdade dos módulos das forças elétrica (de atração do elétron ao núcleo) e centrípeta (do movimento circular do elétron em torno do núcleo).
Dessa forma, ele desenvolveu uma expressão para a energia que depende de um número quântico, n, que indica o nível de energia eletrônica e determina o raio.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O modelo atômico de Bohr permitiu descrever com sucesso o raio do movimento circular do elétron em torno do núcleo de hidrogênio no estado fundamental. ( ) O modelo atômico de Bohr permitiu descrever com sucesso a diferença de energia entre dois níveis eletrônicos do átomo de hidrogênio. ( ) O modelo atômico de Bohr permitiu descrever com sucesso o comprimento de onda associado a excitações eletrônicas em átomos de qualquer número atômico.
As afirmativas são, respectivamente,