Questões de Concurso
Foram encontradas 3.161 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
Texto para a questão.
A solubilidade é um dos temas mais relevantes da área da química, tanto por sua importância intrínseca quanto pela variedade de fenômenos e propriedades químicas envolvidas em seu entendimento. O processo de solubilização de uma substância resulta da interação entre a espécie que se deseja solubilizar (soluto) e a substância que a dissolve (solvente) e pode ser definida como a quantidade de soluto que dissolve, em uma determinada quantidade de solvente, em condições de equilíbrio. Solubilidade é, portanto, um termo quantitativo.
C. R. Martins, W. A. Lopes e J. B. Andrade. Solubilidade das
substâncias orgânicas. In: Química Nova, v. 36, n.° 8,
2013, p. 1.248-1.255 (com adaptações).
SKOOG, D. A.; KOLLER, F. J.; NIEMAN, T. A. Princípios da Análise Instrumental. 5ª ed. Porto Alegre: Bookman, 2002.
Com relação aos princípios da técnica de cromatografia iônica, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Íons monovalentes ficam retidos na coluna de troca iônica mais fortemente que íons polivalentes. ( ) Resinas trocadoras de cátions comuns exibem sítios ativos que contém grupos ácidos sulfônicos ou carboxílicos. ( ) A ordem de eluição em colunas trocadoras de ânions esperada para os haletos é F- , Cl- , Br- , I- .
Segundo a ordem apresentada, as afirmativas são, respectivamente,
1) H2S (aq) + 4 Cl2 (aq) + 4 H2O (liq)
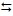 8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq)
8 HCl (aq) + H2SO4 (aq)
2) 2 Fe(HCO3)2 (aq) + Cl2 (aq) + Ca(HCO3)2 (aq) 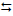 2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq)
2 Fe(OH)3 (s) + CaCl2
(aq) + 6 CO2 (g)
3) MnSO4 (aq) + Cl2 (aq) + 4 NaOH (aq) 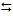 MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
MnO2 (ppt) + 2 NaCl (aq) +
Na2SO4 (aq) + 2H2O (liq)
Analise as afirmativas a seguir, relacionadas com as reações.
I. Na reação 1, o enxofre sofre oxidação e o cloro é o agente redutor. II. Na reação 2, o ferro sofre oxidação e o cloro sofre redução. III. Na reação 3, o manganês sofre redução e o cloro é o agente oxidante.
Está correto o que se afirma em
A alcalinidade total da amostra, em mgCaCO3.L-1, corresponde aproximadamente a
Dados: massas molares em g.mol-1: C = 12; O = 16; Ca = 40. Equação para a titulação: 2HCl + CaCO3 → CaCl2 + H2O + CO2.
Se a quantidade de matéria orgânica e de microrganismos aeróbios no esgoto for alta, a diminuição da concentração de oxigênio dissolvido no meio provocará alterações no ambiente aquático.
A quantidade de oxigênio necessária para o consumo da matéria orgânica pode ser avaliada em laboratório, utilizando o excesso do reagente
O volume previsto de titulado que deverá ser gasto nesse processo, considerando nenhum tipo de perda será de
Dados: massas molares (g.mol-1) C= 12; O=16; Na= 23.
A adição de NH3(aq) a uma solução saturada de cloreto de prata em contato com o precipitado resultará
2SO3(g)
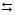 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,
Assinale a opção que indica o par que pode ser utilizado para o preparo de um tampão básico.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Na = 23.
Considere um tubo selado contendo inicialmente N2O4 com pressão parcial de 0,45 atm. e temperatura constante. Após o equilíbrio ser atingido, a pressão parcial determinada para o N2O4 foi de 0,08 atm.
Com base nesses dados experimentais, o valor aproximado da constante de equilíbrio em função das pressões parciais dos gases envolvidos, é de
Responsável pelo abastecimento de 12 milhões de pessoas na Região Metropolitana do Rio (80% da população), o Rio Paraíba do Sul está na iminência de uma catástrofe em Volta Redonda, no Sul Fluminense. O alerta consta na denúncia 1518/18, aceita pelo Ministério Público Federal, que abriu inquérito para apurar responsabilidades (...) A ação adverte para o risco de deslizamento de uma pilha gigante, sem contenção, de escória. Adaptado de https://odia.ig.com.br/rio-de-janeiro/2018 Acesso em 18/06/2018
A pilha de escória contém areia, cal virgem, enxofre e metais tóxicos como manganês, zinco, cádmio, crômio, níquel e chumbo e corre o risco de escorregar com a ação das chuvas e contaminar o rio Paraíba do Sul e os lençóis freáticos.
Assinale a opção que indica o problema ambiental que esta contaminação pode causar ao ambiente aquático.
A imagem abaixo representa o modelo cinético molecular dos diferentes estados de agregação das moléculas da água.
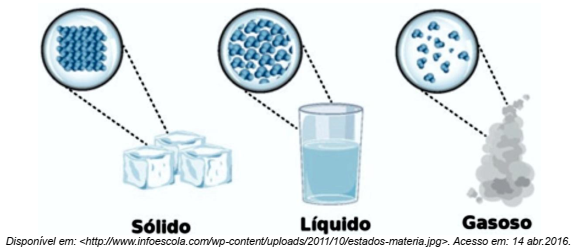
De acordo com esse modelo, no estado físico sólido, as moléculas estão
O teste de chamas, utilizado para a detecção qualitativa de alguns cátions metálicos, é possível porque o comprimento de onda da luz visível emitida por cada átomo/íon é percebido como cor. Observe a tabela com os comprimentos de onda no vácuo referentes ao espectro da luz visível.
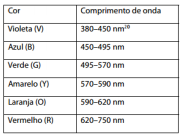
Em um ensaio de chama, para evitar confusões visuais das cores, a detecção foi realizada com auxílio de um
Colorímetro, que apresentou, para as amostras aquosas A, B e C, os comprimentos de onda 425 nm, 540 nm e 580 nm,
respectivamente. É correto afirmar que as amostras, nesta ordem, contêm cátions dos metais:
O modelo para o átomo proposto por Thomson está representado abaixo.
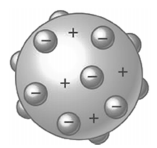
(http://www.explicatorium.com/images/modelo-Thomson.jpg. Acesso em 03/01/2016)
Com esse modelo, Thomson interpretou
Considere os seguintes compostos:

São isômeros trans e cis do isoeugenol os compostos