Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
( ) Na oxidação do ferro exposto ao tempo, no anodo ocorre a reação Fe → Fe2+ + 2e − e no catodo ocorre a reação O2 +4H + + 4e − → 2H2O.
( ) Uma forma de proteger a oxidação do ferro e fazer uma proteção catódica, é usar um metal de sacrifício como o magnésio. Isso ocorre pois o ferro possui um potencial de redução mais negativo que o magnésio.
( ) A proteção de superfícies metálicas da corrosão independe do meios corrosivos existentes, sendo o meio corrosivo, um fator secundário da corrosão.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
A estrutura da proteína basicamente refere-se a sua conformação natural necessária para desempenhar suas funções biológicas. As proteínas são macromoléculas formadas pela união de aminoácidos. Para formar a estrutura primária e uma sequência de aminoácidos, estes se ligam por meio de
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
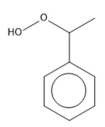
O produto resultante da desoxigenação do hidroperóxido de etilbenzeno é:
(1) Ácido de Lewis ( ) NH3
(2) Base de Arrhenius ( ) CH3COOH
(3) Base fraca de Bronsted-Lowry ( ) KNO3
(4) Ácido forte de Bronsted-Lowry ( ) HCl
(5) Componente ácido de tampão ( ) NH4Cl
(6) Componente salino de tampão ácido ( ) BF3
(7) Sal ácido ( ) CH3COONa
(8) Sal neutro ( ) KOH
A sequência numérica correta de preenchimento dos parênteses da coluna da direita, de cima para baixo, é
H2S LiOH CuBr2 NaNO3 KF SO3 Na2O
Pode-se afirmar que as soluções apresentam, da esquerda para a direita, valores de pH a 25 ºC, conforme listados a seguir:
I - A temperatura de equilíbrio será 50 ºC.
II - A água fria sofre aumento de energia interna e de entropia.
III - A água fria sofre aumento de entalpia e diminuição de entropia.
IV - A água quente sofre diminuição de energia interna e aumento de entropia.
Quais estão corretas?
Líquido Densidade (g/mL) benzeno 0,884 clorofórmio 1,477 éter dietílico 0,710 xileno 0,872
A água salgada do Mar Morto possui densidade igual a 1,240 kg/L, enquanto a da água pura pode ser considerada unitária.
A situação abaixo foi encontrada durante uma extração.
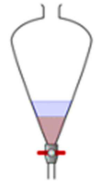
A camada superior e a camada inferior podem ser, respectivamente,
I - Fórmula química do solvente e concentração da solução de limpeza.
II - Concentração comum da solução e concentração molar do soluto.
III - Peso dos metais pesados na solução final e concentração da solução salina.
Quais correspondem aos principais cálculos que devem ser utilizados no preparo de soluções?
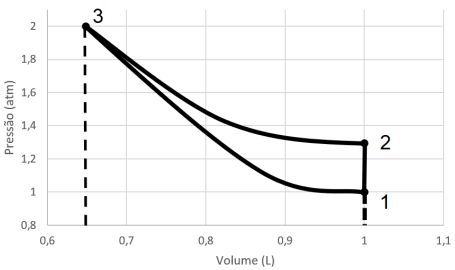
I. A variação de entropia ao longo do ciclo é nula. II. A variação de trabalho ao longo do ciclo é nula. III. A variação de energia interna ao longo do ciclo é nula.
Assinale

Pesos moleculares: I=127 g/mol; K= 39 g/mol; O= 16 g/mol; C=12 g/mol.
