Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Disponível em: Início (mec.gov.br). Acesso em 24 de Julho de 2021.
Neste contexto de proporcionar uma educação integral para os estudantes, visando a construção de uma sociedade mais justa, democrática e inclusiva, a área das ciências da natureza e suas tecnologias (CNT) na qual a Química está inserida deve _______. Assinale a alternativa que preencha corretamente a lacuna.
Disponível em: componente_curricular_bncc_quimica.pdf (sbq.org.br). Acesso em 24 de Julho de 2021.
Neste contexto, relacionamos o ensino de Química aos materiais, sua constituição e propriedades, aos modelos explicativos, a experimentação e as questões sociais, culturais, históricas e econômicas; além das ambientais. Assim, assinale a alternativa incorreta com relação ao ensino de Química:
I. Estimular a instalação de equipamentos que monitoram e diminuem a toxicidade dos gases que são lançados na atmosfera por diversas indústrias pode reduzir a precipitação de chuvas ácidas. II. Evitar a liberação de monóxido de carbono que reage com a água, formando ácido carbônico, um dos principais responsáveis pelo aumento da acidez das chuvas, pode dificultar a precipitação de chuvas ácidas. III. Diversificar a matriz energética por meio da oferta e do uso de fontes renováveis ou alternativas de energia, diminuindo o lançamento de gases na atmosfera resultantes da queima de combustíveis fósseis pode inibir a precipitação de chuvas ácidas. IV. Dificultar a chegada da chuva ácida ao solo, evitando a neblina, que é o principal formato úmido da chuva ácida, responsável pela contaminação e desgaste dos solos, pode amenizar os efeitos negativos da precipitação ácida sobre as plantações.
Estão corretas as afirmativas:
- O gás é formado por moléculas que se encontram em movimento desordenado e permanente. Cada molécula pode ter velocidade diferente das demais. - Cada molécula do gás interage com as outras somente por meio de colisões (forças normais de contato). A única energia das moléculas é a energia cinética. - Todas as colisões entre as moléculas e as paredes do recipiente que contém o gás são perfeitamente elásticas. A energia cinética total se conserva, mas a velocidade de cada molécula pode mudar. - As moléculas são infinitamente pequenas. A maior parte do volume ocupado por um gás é espaço vazio.
Seguindo estes quatro postulados, Boltzmann e Maxwell mostraram a relação entre a energia cinética média do total de moléculas de um gás ideal e sua temperatura conforme a expressão:
PV = 2/3 N { ½ m[v 2 ]} ½ m[v 2 ] = 3/2 kT Onde: N = número de moléculas; k (constante de Boltzmann) = 1,38.10 -23 J/K; T = temperatura absoluta (Kelvin)
Considere que o gás seja ideal, mantido em um recipiente isolado e fechado hermeticamente, e assinale a alternativa correta de acordo com a teoria cinética dos gases.
Neste trecho da música do Emicida, a preocupação com o uso dos recursos naturais é notória. E nos faz refletir sobre as questões ambientais e suas implicações tecnológicas, sociais e científicas que fazem parte da nossa vida pessoal e profissional. Sendo assim, assinale a alternativa que apresenta quais problemáticas ambientais podemos relacionar ao trecho da música Passarinhos, de Emicida.
Adaptado.Produção de Alumínio: Extração da Bauxita, Obtenção na Eletrólise (culturalivre.com). (Acesso em 24 de Julho de 2021).
Podemos resumir a reação de obtenção do alumínio a partir do óxido de alumínio por meio da seguinte equação química balanceada. 2 Al2O3 (l) + 3 C(s) → 4 Al (l) + 3 CO2 (g) Dados: Massas atômicas (g/mol) Al=27; C=12; O=16. Assinale a alternativa que apresenta a massa, em gramas, de alumínio produzida se tivermos o triplo da quantidade, em mol, de óxido de alumínio e carvão.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.
- O ar expelido pelos pulmões do suspeito é bombeado em uma solução de dicromato de potássio fortemente acidulada (ácido sulfúrico); - O etanol presente na boca do motorista (se este consumiu bebida alcoólica) reage com os íons dicromato da solução, produzindo acetaldeído e íons Cromo (III); - Em razão da reação química, ocorre uma mudança na cor da solução, a cor característica laranja passa para um tom esverdeado, acusando a presença de álcool etílico ou etanol.
Adaptado. Composição química do Bafômetro - Mundo Educação (uol.com.br). (Acesso em 23 de Julho de 2021)
A reação que ocorre no bafômetro com dicromato de potássio está representada pela equação química não balanceada a seguir:
K2Cr2O7(aq) + x H2SO4(aq) + 3CH3CH2OH(g) → alaranjado incolor
Cr2(SO4)3(aq) + y H2O(l) + 3CH3CHO(g) + K2SO4(aq) verde incolor
Assinale a alternativa que relaciona a classificação e os respectivos valores de x e y (mínimos coeficientes inteiros) que balanceiam corretamente a reação do bafômetro com dicromato de potássio.
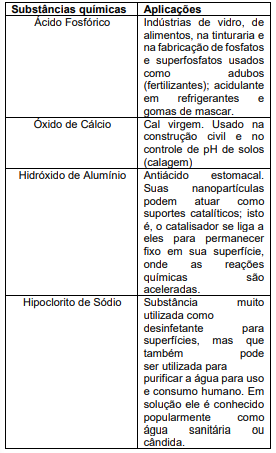
Assinale a alternativa que apresenta as fórmulas químicas que representam as substâncias presentes na tabela acima.
Adaptado.https://www.embrapa.br/documents/1355126/49258452/e mbrapa.br-Corre%C3%A7%C3%A3o+do+Solo+- +Portal+Embrapa.pdf/8a01a49d-0b94-c4e4-ea38- 5682ceb37955. (Acesso em 23 de Julho de 2021).
O processo de calagem do solo citado anteriormente no texto refere-se à utilização de calcário (CaCO3) para diminuir a acidez dos solos. Assim, quando o carbonato de cálcio é adicionado ao solo, ele pode reagir de vários modos. Assinale a alternativa que apresenta as equações químicas que podem ocorrer neste processo.
Adaptado. Chapter 9 Molecular Geometries and Bonding Theories (ufpr.br). (Acesso em 23 de Julho de 2021).
Observe a tabela a seguir. E assinale a alternativa que apresenta a sequência que relaciona corretamente a substância ou o íon à sua geometria molecular, respectivamente.
Substâncias/íons Geometria Molecular I. NH3 ( ) Angular II. PH4+ ( ) Linear III. H2O ( ) Tetraédrica IV. CO2 ( ) Piramidal
Dados: Números atômicos (Z) H = 1; C = 6; N = 7; O = 8; P =15.
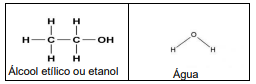
Após observar as fórmulas estruturais do etanol e da água, reconhecemos que o etanol se dissolve em água devido à formação de______:
Assinale a alternativa que preencha corretamente a lacuna.
Elementos Químicos Distribuição Eletrônica
I 1s2 2s2 2p6 3s23p3 II 1s2 2s2 2p6 3s2 3p6 4s2 3d8 III 1s2 2s2 2p6 3s2 3p6 4s2 IV 1s2 2s2 2p6 3s2 3p6 4s23d10 4p3 V 1s2 2s2 2p6 3s2 3p
De acordo com as informações localizadas na tabela acima, é correto afirmar que:
A tabela periódica dos elementos químicos relaciona os elementos em linhas (Períodos) e colunas (Grupos ou Famílias), dispostos em ordem crescente de seus números atômicos. As propriedades dos elementos químicos presentes no mesmo grupo são semelhantes. Neste contexto, considere os seguintes elementos químicos e seus respectivos números atômicos.
Césio (Cs) Z = 55
Enxofre (S) Z = 16
Argônio (Ar) Z = 18
Magnésio Mg) Z =12
A partir dessas informações assinale a
alternativa correta.
I. O átomo era uma esfera não maciça, contendo carga elétrica positiva e negativa distribuídas em harmonia. O átomo teria carga elétrica total nula. II. O átomo não seria maciço como proposto por estudos anteriores. Seria descontínuo, nucleado e composto por duas regiões (O núcleo e a eletrosfera). III. O átomo era uma partícula minúscula, maciça, esférica e indivisível, não podendo ser criado nem destruído. IV. As órbitas elípticas indicaram um segundo número quântico (número quântico secundário), explicando como os espectros de emissão de luz apresentavam o fenômeno de linhas múltiplas nas raias espectrais. V. Os elétrons não giram aleatoriamente ao redor do núcleo, mas se movimentam ao redor do núcleo, em órbitas circulares determinadas. E cada órbita circular de elétrons apresentava um nível de energia definida e constante.
( ) Modelo de Dalton; ( ) Modelo de Thomson; ( ) Modelo de Rutherford; ( ) Modelo de Bohr; ( ) Modelo de Sommerfeld.
Assinale a alternativa que apresenta a sequência correta que associa os modelos atômicos aos seus respectivos responsáveis
Adaptado. Oxigênio Hospitalar (mixandi.com.br). Acesso em 24 de Julho de 2021.
Considere a seguinte situação hipotética. Temos em um hospital, um cilindro contendo gás oxigênio hospitalar com volume de 15 m3 , mantido à temperatura de -23 ℃ e à pressão de 25 atm. Assinale a alternativa que apresenta a quantidade, em mols, e a massa, em quilogramas (Kg), de O2 que estão contidas neste cilindro. Considere o O2 um gás ideal. Dados: R = 0,082 atm.L.K-1 .mol-1 ; M.M do gás O2 (g/mol) = 32.
A pilha de lítio, muito leve por conta da baixa densidade desse metal, foi utilizada inicialmente apenas em marca-passos cardíacos. As semirreações que ocorrem numa pilha de lítio podem ser descritas por:
A diferença de potencial gerada por essa pilha, em volts, é igual a: