Questões de Concurso Para engenheiro de equipamento júnior - inspeção
Foram encontradas 337 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
I - A sobrevoltagem na polarização por ativação é diretamente proporcional à densidade de corrente.
II - A sobrevoltagem na polarização por concentração é inversamente proporcional ao número de elétrons associados à ionização de cada átomo metálico.
III - Na polarização combinada por ativação e concentração, a sobrevoltagem é maior na polarização por ativação do que na polarização por concentração para reações de redução.
Está correto o que se afirma em
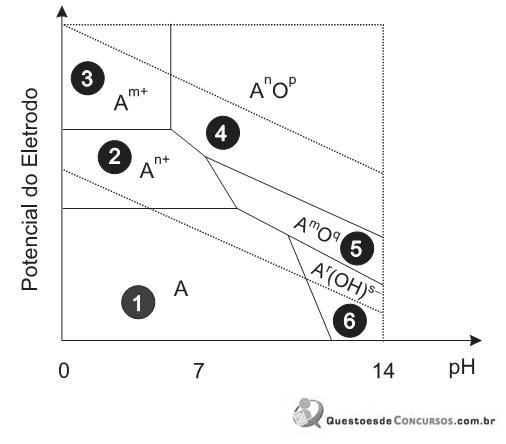
Ao observar o diagrama de Pourbaix isotérmico acima para um metal A (cujos coeficientes m, n, p, q, r e s são valores inteiros que generalizam o gráfico), conclui-se que a passivação desse metal ocorre na(s) região(ões)
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir
I - Entre uma chapa metálica e um anel de vedação de borracha, que se degradou com o uso, formou- se uma região com umidade e pouca aeração, ocorrendo corrosão a partir de uma pilha galvânica entre a região aerada da chapa (catódica) e a não aerada (anódica).
II - Em uma peça metálica, formou-se um depósito isolado de restos de pintura sobre uma das superfícies expostas a uma solução salina, ocorrendo a corrosão em função da diferença de potenciais entre a região sob o depósito de pintura e a região sem depósito.
III - Uma cavidade, em formato de fenda longilínea, é perpendicular à superfície exposta a uma solução, sendo que a pilha galvânica veio a se formar entre a região oclusa da peça e a solução aquosa que se aloja no interior da fenda.
É(São) correta(s) a(s) situação(ões)
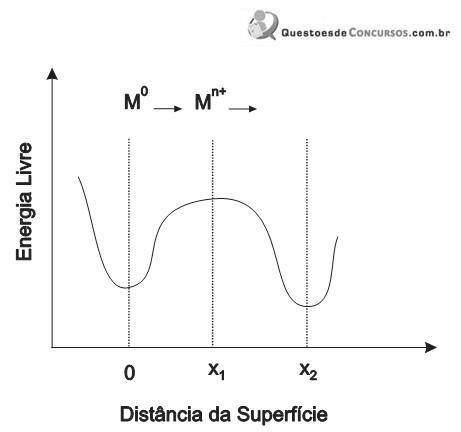
A energia que os átomos reagentes requerem para iniciar uma reação é chamada de energia livre de ativação. Observando o gráfico acima, que relaciona a energia livre com a distância do ponto até a superfície exposta a um solvente polar, como a água, conclui-se ser INCORRETO considerar que