Questões de Concurso
Para engenharia química
Foram encontradas 2.418 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativo à análise gravimétrica e aos fatores que a influenciam.
Na gravimetria, para facilitar a filtração, é indicado, após
obtenção de um sólido cristalino, passar o precipitado obtido
por uma etapa de digestão lenta sem agitação.
Tendo em vista que, apesar da grande variedade de métodos instrumentais disponíveis atualmente, diversos métodos clássicos ainda persistem como métodos padrão para diversas análises, a exemplo da gravimetria, julgue o item que se segue, relativo à análise gravimétrica e aos fatores que a influenciam.
A técnica gravimétrica de precipitação em solução homogênea
consiste na precipitação do analito por um agente precipitante
que é gerado por uma reação química lenta na própria solução.
O biodísel pode ser obtido a partir da reação de transesterificação do óleo de soja catalisada por base. Com o objetivo de aumentar o rendimento do produto dessa reação em bancada, foi aplicada a metodologia de planejamento fatorial, sendo os fatores, níveis estudados e efeitos obtidos apresentados na tabela abaixo.

Considerando as informações acima apresentadas, julgue o item a
seguir, relativo à otimização da reação e ao planejamento de
experimentos realizados.
A distribuição da concentração de metais em cinzas de cigarros é uma fonte importante de informação que pode ser utilizada na área forense para identificar marcas de tabaco. Com esse objetivo, as concentrações de Zn, B, Mn, Fe, Mg, Cu, Ti, Al, Sr, Ca, Ba, Na, Li e K foram determinadas em duas marcas de tabaco (A e B) por espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES). Para facilitar a interpretação dos dados, foi aplicada a técnica quimiométrica de análise de componentes principais (PCA). As figuras I e II abaixo apresentam os gráficos de escores e pesos obtidos, em que PC1 é o componente principal 1 e PC2 é o componente principal 2.


J.L. Pérez-Bernal, J.M. Amigo, R. Fernández-Torres, M.A. Bello, M. Callejón-Mochón. Forensic Sci. Int., 204/2011, 119–125) (com adaptações).
Com relação às técnicas de absorção e emissão atômica e à análise
dos dados acima, julgue o item.
A distribuição da concentração de metais em cinzas de cigarros é uma fonte importante de informação que pode ser utilizada na área forense para identificar marcas de tabaco. Com esse objetivo, as concentrações de Zn, B, Mn, Fe, Mg, Cu, Ti, Al, Sr, Ca, Ba, Na, Li e K foram determinadas em duas marcas de tabaco (A e B) por espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES). Para facilitar a interpretação dos dados, foi aplicada a técnica quimiométrica de análise de componentes principais (PCA). As figuras I e II abaixo apresentam os gráficos de escores e pesos obtidos, em que PC1 é o componente principal 1 e PC2 é o componente principal 2.


J.L. Pérez-Bernal, J.M. Amigo, R. Fernández-Torres, M.A. Bello, M. Callejón-Mochón. Forensic Sci. Int., 204/2011, 119–125) (com adaptações).
Com relação às técnicas de absorção e emissão atômica e à análise
dos dados acima, julgue o item.
A distribuição da concentração de metais em cinzas de cigarros é uma fonte importante de informação que pode ser utilizada na área forense para identificar marcas de tabaco. Com esse objetivo, as concentrações de Zn, B, Mn, Fe, Mg, Cu, Ti, Al, Sr, Ca, Ba, Na, Li e K foram determinadas em duas marcas de tabaco (A e B) por espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES). Para facilitar a interpretação dos dados, foi aplicada a técnica quimiométrica de análise de componentes principais (PCA). As figuras I e II abaixo apresentam os gráficos de escores e pesos obtidos, em que PC1 é o componente principal 1 e PC2 é o componente principal 2.


J.L. Pérez-Bernal, J.M. Amigo, R. Fernández-Torres, M.A. Bello, M. Callejón-Mochón. Forensic Sci. Int., 204/2011, 119–125) (com adaptações).
Com relação às técnicas de absorção e emissão atômica e à análise
dos dados acima, julgue o item.
A distribuição da concentração de metais em cinzas de cigarros é uma fonte importante de informação que pode ser utilizada na área forense para identificar marcas de tabaco. Com esse objetivo, as concentrações de Zn, B, Mn, Fe, Mg, Cu, Ti, Al, Sr, Ca, Ba, Na, Li e K foram determinadas em duas marcas de tabaco (A e B) por espectrometria de emissão atômica com plasma indutivamente acoplado (ICP-AES). Para facilitar a interpretação dos dados, foi aplicada a técnica quimiométrica de análise de componentes principais (PCA). As figuras I e II abaixo apresentam os gráficos de escores e pesos obtidos, em que PC1 é o componente principal 1 e PC2 é o componente principal 2.


J.L. Pérez-Bernal, J.M. Amigo, R. Fernández-Torres, M.A. Bello, M. Callejón-Mochón. Forensic Sci. Int., 204/2011, 119–125) (com adaptações).
Com relação às técnicas de absorção e emissão atômica e à análise
dos dados acima, julgue o item.
αB2O3(s) + βHF(g) → yBF3(g) + δH2O(g)
Considerando que, na equação química acima, as energias livres padrão de formação são ΔG°(B2O3(s)) = -1.200 kJ/mol; ΔG°(HF(g)) = -270 kJ/mol; ΔG°(BF3(g)) = -1.120 kJ/mol e ΔG°(H2O(g)) = -230 kJ/mol; e que a reação química é realizada em um recipiente que contém um êmbolo móvel que permite controlar o volume do sistema, julgue o item a seguir, acerca de termodinâmica e equilíbrio químico.
A variação da energia livre de Gibbs em função do avanço da
reação será igual a zero na condição de equilíbrio químico,
enquanto essa variação terá valor positivo quando o meio
estiver com maior concentração de reagentes em relação à
condição de equilíbrio – estado considerado endergônico.
αB2O3(s) + βHF(g) → yBF3(g) + δH2O(g)
Considerando que, na equação química acima, as energias livres padrão de formação são ΔG°(B2O3(s)) = -1.200 kJ/mol; ΔG°(HF(g)) = -270 kJ/mol; ΔG°(BF3(g)) = -1.120 kJ/mol e ΔG°(H2O(g)) = -230 kJ/mol; e que a reação química é realizada em um recipiente que contém um êmbolo móvel que permite controlar o volume do sistema, julgue o item a seguir, acerca de termodinâmica e equilíbrio químico.
A energia livre padrão da reação é de -110 kJ/mol, o que
indica que essa reação é espontânea no que se refere à
formação dos produtos.
αB2O3(s) + βHF(g) → yBF3(g) + δH2O(g)
Considerando que, na equação química acima, as energias livres padrão de formação são ΔG°(B2O3(s)) = -1.200 kJ/mol; ΔG°(HF(g)) = -270 kJ/mol; ΔG°(BF3(g)) = -1.120 kJ/mol e ΔG°(H2O(g)) = -230 kJ/mol; e que a reação química é realizada em um recipiente que contém um êmbolo móvel que permite controlar o volume do sistema, julgue o item a seguir, acerca de termodinâmica e equilíbrio químico.
A variação da entropia de um sistema em função da
temperatura é descrita pela distribuição de Boltzmann, que
estabelece que, à medida que a temperatura de um sistema
aumenta, as suas moléculas movimentam-se mais rapidamente,
o que implica uma redução do número de microestados.
Considere que um gás A contendo um soluto C é alimentado em uma coluna de absorção. A vazão do gás A é 50.000 kg/h (base livre de C), e o percentual de soluto C nele presente é 2% (massa de C/massa de A). No processo, utiliza-se, para a retirada do soluto, 10.000 kg/h de água (B), e a solução aquosa que deixa a coluna contém 2,92% de C (em massa).
Então, a vazão (kg/h) e o percentual do soluto C na corrente gasosa final na base livre do soluto são, respectivamente:
Analise as afirmativas a seguir, acerca da razão de refluxo (R) em uma operação de destilação, assinalando com V as verdadeiras e com F as falsas.
( ) A razão de refluxo total corresponde ao número mínimo de pratos da coluna e a um custo fixo infinito.
( ) Um aumento acentuado de R implica a diminuição do diâmetro da coluna, visto que as quantidades de líquido e vapor reciclados por unidade de alimentação tornam-se bem menores, o que leva a uma diminuição no custo total (soma dos custos fixos e operacionais) de operação da coluna.
( ) A razão de refluxo mínima corresponde à razão máxima que irá requerer um número infinito de pratos para a separação desejada, e, nessa condição, os custos com calor para o refervedor, água de resfriamento para o condensador e potência para a bomba de refluxo são mínimos.
( ) A razão de refluxo ótima, que deve ser utilizada na operação, é aquela em que o custo fixo for mínimo.
Assinale a sequência CORRETA.
Considere a evaporação de água de um reservatório, à temperatura ambiente, em um ambiente aberto cuja umidade é igual a 60%.
Nesse contexto, é incorreto afirmar que:
Observe as curvas características de uma bomba centrífuga apresentadas na figura a seguir.
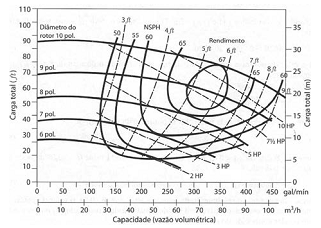
Considerando que essa bomba está operando com uma
vazão de 50 m3
/h e uma carga total de 20 m, quais são
os valores corretos a serem utilizados para o diâmetro
do rotor, a potência e o rendimento dessa bomba,
respectivamente?
Em um processo contínuo, tem-se uma corrente de alimentação de 100 moles/h de uma mistura 30-70 (molar) de benzeno (B) e tolueno (T), que deverá ser separada em duas frações, cada uma delas com as seguintes características.
Corrente de topo
Vazão molar: 20 moles/h
Composição:
0,95 mol B/mol
0,05 mol T/mol
Corrente de fundo
Vazões molares:
11 moles B/h
69 moles T/h
Pretende-se escalonar o processo para uma nova vazão de alimentação de 1.500 moles/h.
Considerando-se que se deseja atingir essa mesma separação, quais serão os novos valores para as vazões molares da corrente de topo (vazão total) e para as vazões de B e de T na corrente de fundo, respectivamente?