Questões de Vestibular
Sobre gás ideal em física
Foram encontradas 115 questões
Ao carregar uma dessas espingardas, um êmbolo comprime 120 mL de ar atmosférico sob pressão de 1 atm, reduzindo seu volume para 15 mL. A pressão do ar após a compressão será, em atm,
Admita que o ar se comporte como um gás ideal e que o processo seja isotérmico.
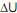 . O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.
. O gás segue a equação geral dos gases (pV=nRT) nos processos termodinâmicos apresentados.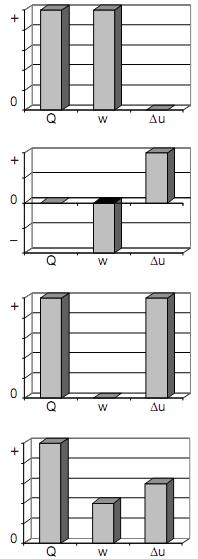
De acordo com os respectivos histogramas, em ordem de apresentação, de cima para baixo, os processos podem ser:
Dados:
Massa atômica do Carbono: 12 u
Massa atômica do Oxigênio: 16 u
Constante universal dos gases:
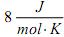
O número CORRETO de caixas necessário para armazenar a massa de gás carbônico produzida por esta pessoa durante um ano é:
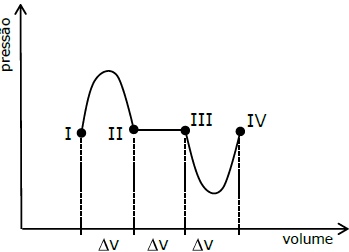
O processo 1 tem estado inicial I e final II, o processo 2 tem estado inicial II e final III, e o processo 3 tem estado inicial III e final IV.
A relação entre os trabalhos Wi (i = 1, 2, 3) nos processos 1, 2 e 3, respectivamente, é melhor estimada por
Considerando que a máquina trabalha com um gás ideal, leia os itens abaixo:
I. A máquina pode ser representada por um ciclo com duas transformações adiabáticas reversíveis e duas transformações isotérmicas reversíveis.
II. Se o ciclo desta máquina consiste de uma expansão isotérmica, uma expansão adiabática, uma compressão isotérmica e uma compressão adiabática, respectivamente, então ocorre transformação de calor em trabalho útil.
III. O rendimento da máquina é maior do que 40%.
IV. A cada ciclo uma quantidade de calor maior que 700J é rejeitada para a fonte fria.
Marque a opção CORRETA:
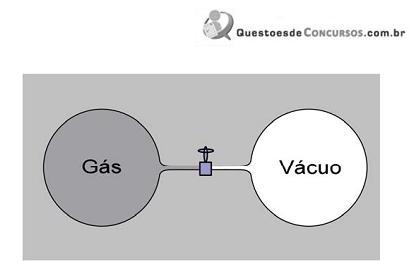
A figura acima é composta por dois recipientes: o da esquerda, inicialmente, está preenchido por uma grande quantidade de gás (alta massa específica), enquanto no outro foi constituído um vácuo. Uma válvula, inicialmente fechada, conecta os dois recipientes. O sistema todo está termicamente isolado da vizinhança por paredes rígidas e, consequentemente, nenhuma energia pode ser transferida para o sistema ou retirada do sistema. Quando a válvula é aberta, o gás rapidamente se distribui em todo o recipiente, realizando um processo chamado expansão livre.
De acordo com as informações acima, pode-se garantir, para esse gás, que
– a garrafa foi bem fechada, à temperatura ambiente de 27 ºC, e não houve vazamento de ar;
– a temperatura do freezer era de –18 ºC;
– houve tempo suficiente para o equilíbrio térmico;
– a pressão interna do freezer tem de ser menor do que a pressão ambiente (pressão atmosférica).
Assim, o professor pôde concluir que o estudante:


