Questões de Vestibular
Sobre transformações gasosas em física
Foram encontradas 100 questões

Sabendo que não houve variação da temperatura (298 K) e do volume do frasco, e que a pressão final no frasco foi de 2,0 atm, assinale a alternativa que apresenta, correta e respectivamente, a quantidade, em mols, de argônio e de oxigênio contidos na alíquota de 5,0 L da seringa.
Dados: Massa atômica doH=1u R = 0,082 atm.L.K−1.mol−1
Considere as três afirmativas abaixo, em relação a um gás ideal.
I - Em uma compressão adiabática, a temperatura final do gás não pode ser maior do que a inicial, pois nenhum calor é trocado com a vizinhança.
II - Em um processo isocórico (isovolumétrico), nenhum trabalho é realizado pelo gás.
III - Em um processo isobárico, o trabalho realizado pelo gás é proporcional ao quadrado da variação do volume.
Marque a única opção CORRETA:
Dado: R = 8,3 J/mol.K.
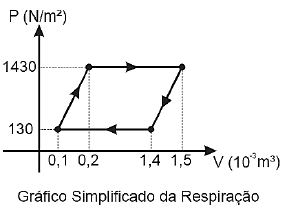
Qual é o módulo do trabalho realizado em um ciclo respiratório?
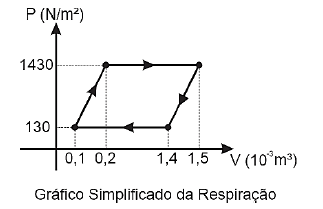
Qual é o módulo do trabalho realizado em um ciclo respiratório?
(https://sbmh.com.br. Adaptado.)
Considere que o ar se comporta como um gás ideal, que o ar no interior da câmara hiperbárica esteja à pressão atmosférica, que o volume da câmara hiperbárica não se altere e que a temperatura no seu interior não varie. O número de mols de ar que devem ser injetados na câmara, em relação à quantidade existente inicialmente (n0 ), para produzir no interior da câmara uma pressão igual a 2,8 vezes a pressão atmosférica é
Antes de viajar, o motorista calibrou os pneus do seu carro a uma pressão de 30psi quando a temperatura dos pneus era de 27ºC. Durante a viagem, após parar em um posto de gasolina, o motorista percebeu que os pneus estavam aquecidos. Ao conferir a calibragem, o motorista verificou que a pressão dos pneus era de 32psi.
Considerando a dilatação do pneu desprezível e o ar dentro dos pneus como um gás ideal, assinale a alternativa que MELHOR representa a temperatura mais próxima dos pneus.
Um sistema de massa constante, constituído por um gás ideal, está no estado inicial de volume V0 , pressão P0 e temperatura T0 . Quando o sistema evolui para um novo estado de volume V0/2 e pressão P0/2 , sua temperatura é
A teoria cinética dos gases apresenta um modelo microscópico para o gás ideal.
De acordo com essa teoria, as moléculas de um gás