Questões de Vestibular
Sobre cinética química em química
Foram encontradas 267 questões
Para calcular a velocidade de uma reação, podemos medir a quantidade de reagentes consumidos ou a quantidade de produtos formados por unidade de tempo. A figura abaixo representa um experimento no qual misturou-se 50 mL de uma solução de ácido clorídrico 0,1 mol L-1 com um grama de magnésio metálico. Observe o gráfico do volume do gás Hidrogênio formado versus tempo.

I - No instante t = 60 s, a velocidade da produção do gás hidrogênio é maior que a velocidade de consumo de Mg (em mols/s).
II - Em qualquer instante após o início da reação, a quantidade de matéria (mol) produzida de gás hidrogênio é o dobro da consumida de ácido clorídrico.
III - A massa de gás hidrogênio produzida é sempre menor que a massa de ácido consumida, em qualquer instante.
Está(ão) correto(s):


Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
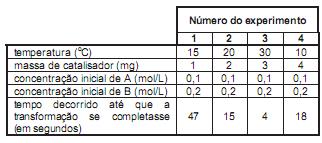
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
Dados: constante de velocidade k = 3.104 L.µmol -1 .mês-1
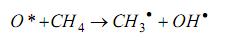
Neste gráfco, está representada a variação de concentração do princípio ativo de um medicamento, em função do tempo, nas temperaturas I e II:
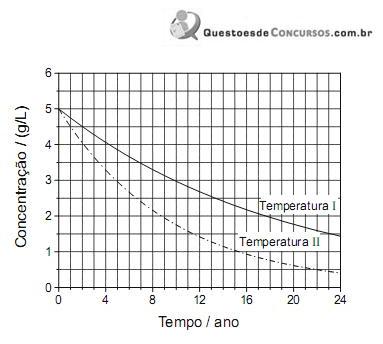
Considerando-se essas informações, é CORRETO afrmar que
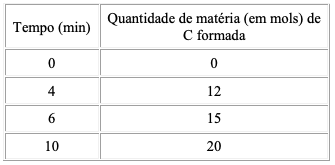
Num experimento, foram misturados, em um recipiente, 5 mol de X com 5 mol de Y. Após 1 minuto, nesse recipiente, havia 4 mol de X, 3 mol de Y e 1 mol de Z, como registrado neste quadro:
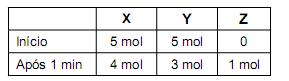
Suponha que essa reação prossegue até o consumo total do reagente limitante.
Considerando-se a quantidade inicial de X e Y, é CORRETO afrmar que a quantidade máxima de Z a ser obtida nessa reação é de
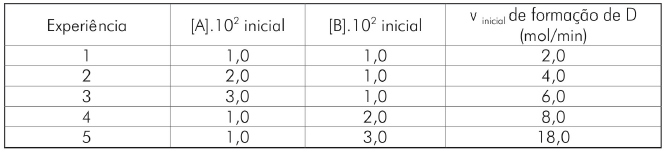
A lei da velocidade para a reação hipotética é fornecida pela equação
A partir da análise da tabela, assinale a afirmativa correta.
 qual a velocidade de produção do gás hidrogênio em L s-1 e a massa consumida, aproximadamente, de ácido clorídrico em gramas no instante t = 80 s?
qual a velocidade de produção do gás hidrogênio em L s-1 e a massa consumida, aproximadamente, de ácido clorídrico em gramas no instante t = 80 s?I - No instante t = 60 s, a velocidade da produção do gás hidrogênio é maior que a velocidade de consumo de Mg (em mols/s).
II - Em qualquer instante após o início da reação, a quantidade de matéria (mol) produzida de gás hidrogênio é o dobro da consumida de ácido clorídrico.
III - A massa de gás hidrogênio produzida é sempre menor que a massa de ácido consumida, em qualquer instante.
Está(ão) correto(s):
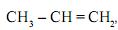 ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila,
ao reagir com o brometo de hidrogênio, HBr, produz uma mistura de dois compostos ? o brometo de n-propila, 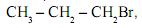 e o brometo de isopropila,
e o brometo de isopropila, 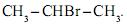
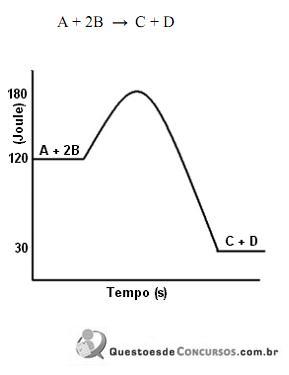
As reações responsáveis pela formação desses compostos estão representadas nestas duas equações:
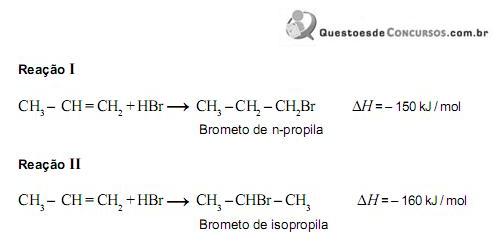
Sabe-se que a velocidade da reação II é maior que a da reação I.
Comparando-se essas duas reações, é CORREtO afrmar que, na II,

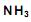 produzido a partir de 28 kg de
produzido a partir de 28 kg de 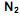 é:
é: 
Considerando essas informações, julgue os itens seguintes.
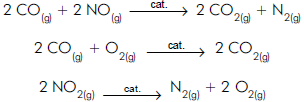
Das seguintes afirmações acerca dessas reações:
I São todas de catálise heterogênea.
II Os catalisadores são consumidos nas reações.
III Os catalisadores aumentam a superfície de contato entre os reagentes.
IV Baixas temperaturas provavelmente aumentam a eficácia dos conversores catalíticos.
Pode-se afirmar que somente a
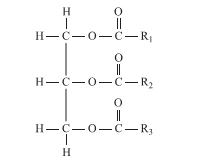
onde
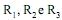 são cadeias abertas de carbono e hidrogênio formadas, em geral, por 13 a 17 átomos de carbono, que po- dem ser iguais ou diferentes, saturadas ou insaturadas, com predominância das insaturadas com até três insaturações. A partir desses óleos, podem ser obtidos diversos produtos de interesse industrial e tecnológico. Como exemplos, considere os seguintes processos:
são cadeias abertas de carbono e hidrogênio formadas, em geral, por 13 a 17 átomos de carbono, que po- dem ser iguais ou diferentes, saturadas ou insaturadas, com predominância das insaturadas com até três insaturações. A partir desses óleos, podem ser obtidos diversos produtos de interesse industrial e tecnológico. Como exemplos, considere os seguintes processos:I. Hidrogenação parcial, catalisada por Ni metálico, formando o produto X.
II. Reação com NaOH, formando glicerol e o produto Y.
III. Reação com
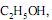 catalisada por KOH, formando glicerol e o produto Z.
catalisada por KOH, formando glicerol e o produto Z.É correto afirmar que os produtos X, Y e Z correspondem, respectivamente, a




