Questões de Vestibular
Sobre cinética química em química
Foram encontradas 267 questões
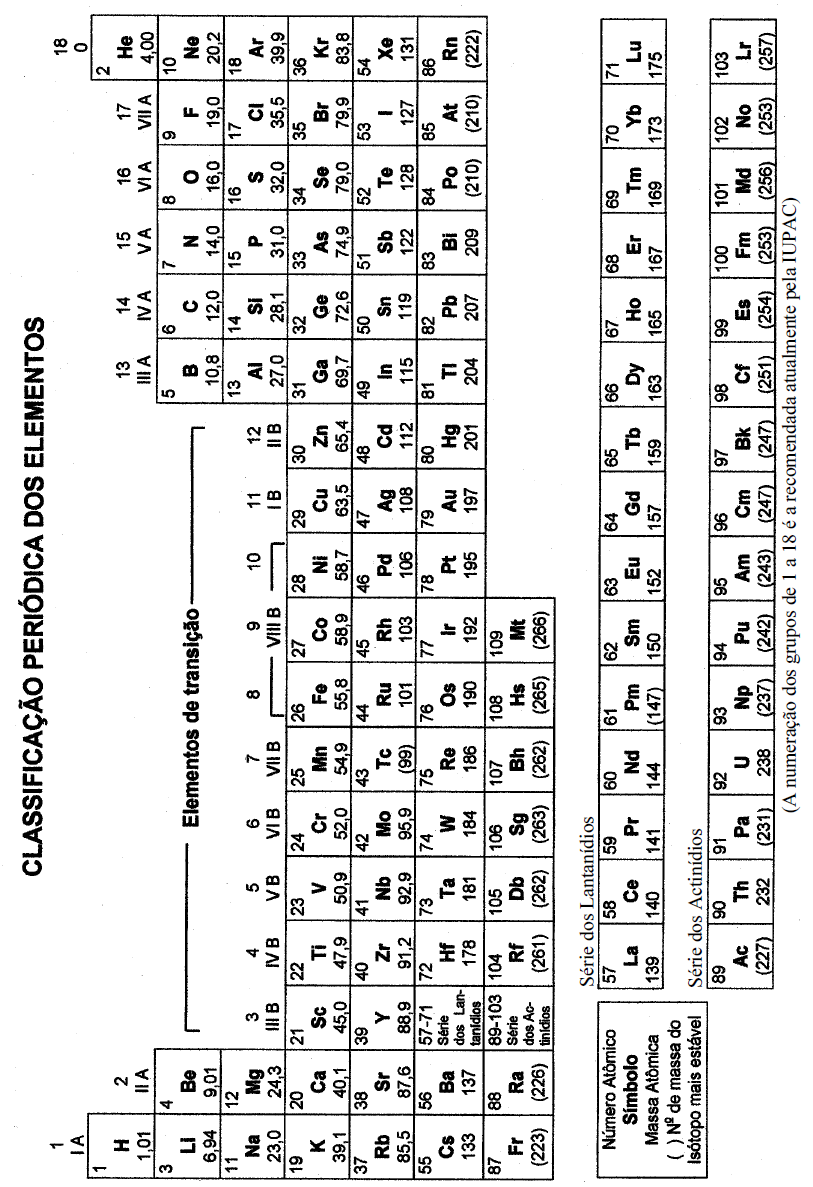
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Reações que envolvem sólidos tendem a prosseguir mais rapidamente se a área superficial dos sólidos for diminuída. Isso pode ser feito diminuindo-se o tamanho das partículas dos sólidos.

Os dados apresentados na tabela foram obtidos a partir de experimentos feitos com a reação de cloreto de iodo, ICl(g) e hidrogênio, H2(g), a determinada temperatura.
Uma análise desses dados permite inferir:
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
Observe a seguinte reação elementar hipotética, representada a seguir, e assinale o que for correto.
A(g) + B(g) → C(g)
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Enzimas são catalisadores naturais presentes em organismos vivos.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Na catálise heterogênea o sistema formado apresenta uma única fase.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Os estados energéticos final e inicial de uma dada reação não são alterados pela presença de
um catalisador.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Os catalisadores são consumidos durante a reação.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Um catalisador aumenta a energia de ativação para uma dada reação.
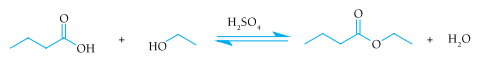
A fim de aumentar a velocidade de formação do butanoato de etila, um dos componentes do aroma de abacaxi, emprega-se como catalisador o ácido sulfúrico. Observe a equação química desse processo:
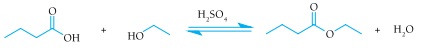
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do
ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico:
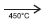 2HI(g) v = k[H2] [I2]
2HI(g) v = k[H2] [I2] O modelo da teoria das colisões, que resultou de estudos dos fatores que influem na velocidade das reações químicas, é uma explicação para o modo como as moléculas de reagentes são clivadas e são formadas as moléculas de produtos de uma reação química.
Admitindo-se a reação química elementar entre o hidrogênio e o iodo, a 450oC, representada pela equação química, a expressão da lei de velocidade dessa reação, e com base na teoria das colisões, para que essa reação ocorra, dentre outros fatores, é preciso que
[ICI] (mol.L-1) [H2] (mol.L-1) Velocidade inicial (mol.L-1.s-1)
1,5 1,5 3,7 . 10-7
3,0 1,5 7,4 . 10-7
3,0 4,5 22 . 10-7
4,7 2,7 X
Os dados apresentados na tabela foram obtidos a partir de experimentos feitos com a reação de cloreto de iodo, ICl(g) e hidrogênio, H2(g), a determinada temperatura.
Uma análise desses dados permite inferir:
A + B
 P
P
Após uma série de quatro experimentos, o estudante representou os dados obtidos em uma tabela:
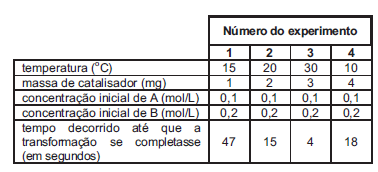
Que modificação deveria ser feita no procedimento para obter resultados experimentais mais adequados ao objetivo proposto?
Quando duplicarmos, simultaneamente, as concentrações de N2(g) e H2(g) a velocidade da reação:
Os expoentes na lei da velocidade de uma reação química, denominados ordem de reação, indicam como a velocidade é afetada pela concentração de cada reagente.
Assim, a partir dessas informações, da equação química de decomposição de N2O5(g) e da expressão da velocidade dessa reação, é correto afirmar:
decomposição térmica do éter dimetílico ocorre de acordo com a equação:
CH3 -O-CH3(g) → CH4(g)+ H2(g) + CO(g).
Em determinadas condições de temperatura e pressão, essa reação apresenta a seguinte relação entre a concentração do éter e a velocidade inicial:
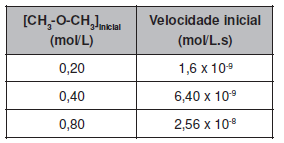
A partir desses dados, é correto afirmar que
As curvas de produção de butanoato de etila para as reações realizadas com e sem a utilização do ácido sulfúrico como catalisador estão apresentadas no seguinte gráfico: