Questões de Vestibular
Sobre estudo da matéria: substâncias, misturas, processos de separação. em química
Foram encontradas 236 questões
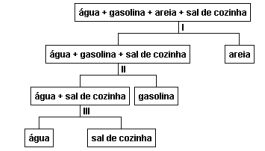
Os processos de fracionamento representados por I, II, e III são, respectivamente:
Este método torna-se inviável quando se trata de:
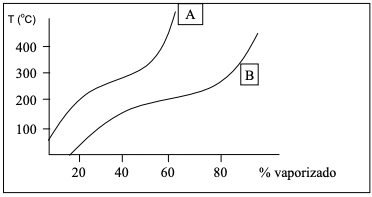
A partir destas informações, indique com (V) as alternativas verdadeiras e com (F) as alternativas falsas. ( ) O petróleo B é mais leve e gera menos resíduo no processo de destilação.
( ) O petróleo A é mais pesado e gera mais resíduo no processo de destilação. ( ) O petróleo A é constituído por frações pesadas que serão craqueadas nas unidades de destilação aumentando o rendimento da refinaria.
( ) Para uma mesma temperatura, o petróleo A gera maior quantidade de frações vaporizadas comparado com o petróleo B. ( ) Para uma mesma temperatura, o petróleo B gera maior quantidade de frações vaporizadas comparado com o petróleo A.
Assinale a alternativa que indique a sequência exata:
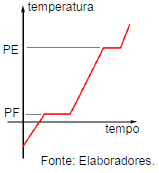
As propriedades físicas como ponto de ebulição (PE) e ponto de fusão (PF) são importantes para auxiliar na diferenciação entre substâncias puras e mistura. O gráfico abaixo representa a curva de aquecimento de X.
A partir do gráfico, pode-se afirmar que X representa
A reação é dada por:
Onde R: CH3 ou C2H5, R1: grupo alquila.
O excesso de metanol utilizado no processo de produção de biodiesel pode constituir um problema ambiental, por isso precisa ser purificado para ser reutilizado no processo. Identifique dentre as figuras a mais adequada para o processo de purificação do metanol:

Os diamantes são um vício. Os iniciados que caem na sedução que emana deles têm diante de pedras poderosas a mesma descarga de adrenalina dos jogadores diante de um lance memorável. O coração dispara, as mãos tremem e, por alguns instantes, nada mais existe no mundo. Da mesma jazida de Letseng, no Lesoto, Sul da África, saíram, nos últimos cinco anos, três diamantes gigantescos: o Promesse de Lesoto, 603 quilates, Legado de Letseng, 493 quilates, e Luz de Letseng, 478 quilates. O diamante e o grafite não só possuem aspectos diferentes, como também propriedades diferentes.
A partir dessas informações, é correto afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

O paracetamol (C8H9NO2) é o princípio ativo do medicamento Tylenol®, utilizado como analgésico e antitérmico. Pode ser comercializado na forma de solução oral (200 mg.mL–1) ou comprimido (500 mg ou 750 mg). É um dos analgésicos mais utilizados, porém é altamente perigoso para o fígado, devido ao seu alto potencial hepatotóxico, não devendo ser utilizados mais do que 8 comprimidos de 500 mg ao dia. Com base nessas informações, assinale o que for correto.

COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O leite é um tipo de colóide classificado como emulsão.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Se a mistura for deixada em repouso após sua agitação e for observada uma separação em duas fases, com volume de 60 mℓ na fase aquosa e 40 mℓ na fase orgânica, a gasolina possui 10% de etanol.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
A mistura final obtida é heterogênea e apresenta 3 fases distintas.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Se o astrônomo utilizasse uma mistura de gases em seu balão, essa mistura poderia ser considerada como homogênea.
1. Adição de 20 mL de água a uma solução aquosa saturada em cloreto de sódio, contendo um grande excesso de sal sedimentado, tal que ainda permaneça precipitado após a adição de mais solvente. 2. Adição de 20 mL de água a uma solução aquosa não saturada em cloreto de sódio. 3. Retirada de fenol, solúvel em água e em éter etílico, de uma solução aquosa, por agitação com uma porção de éter etílico seguida por separação da fase orgânica da fase aquosa. 4. Dissolver glicose em água e a esta solução juntar etanol para que surjam novamente cristais de glicose. 5. Adição de 20 mL de água a nitrato de potássio cristalino.
a) Dissolução b) Extração c) Diluição d) Recristalização
Amostra I: É um gás incolor que liquefaz a uma temperatura de -183° C. Quando submetido a processos usuais de decomposição, permanece a mesma substância. Amostra II: É um sólido branco que apresenta ponto de fusão igual a 800°C e ponto de ebulição igual a 1413°C. Quando submetido à decomposição por eletrólise, origina um sólido metálico e libera um gás. Amostra III: É um líquido límpido e incolor que não mantém uma temperatura constante durante sua ebulição. Após a destilação observa-se a formação de cristais brancos no fundo do recipiente que o contém.
As amostras I, II e III podem ser, respectivamente,
