Questões de Vestibular
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 151 questões

CaO (s) + 3C (s) → CaC2 (s) + CO (g)
Em um experimento em um reator aberto, verificou-se que a diferença entre a massa da mistura reacional e a massa do conteúdo no reator ao término da reação foi 1 400 g.
Dados: massa molar C = 12 g/mol massa molar O = 16 g/mol massa molar Ca = 40 g/mol
A massa de carbono que reagiu foi igual a
Cl2 (g) + NaOH (aq) + H2O (l) → NaClO·5H2O(s) + NaCl (s)
Na preparação de 1 mol de hipoclorito de sódio pentaidratado, a quantidade de água que reage e a quantidade de cloreto de sódio que se forma são, respectivamente,
Um paciente, com recomendação médica para lúpus eritematoso, fez uso da hidroxicloroquina, ingerindo uma dose diária de 400 mg durante 4 semanas.
Afórmula deste composto é dada a seguir.
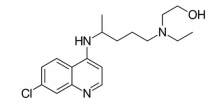
A quantidade de matéria , em mol, de hidroxicloroquina, ingerida pelo paciente ao longo das 4 semanas de tratamento foi de:
(Dado: massa molar da hidroxicloroquina = 335,5
g/mol)
3 Mn3O4 + 8 Al -> 9 Mn + 4 Al2O3
Em uma operação industrial, reagiu-se 13740 kg de Mn3O4 e 6480 kg de Al. Admitindo-se o consumo do reagente limitante por completo, a massa de Mn formado, em quilogramas, é igual a:
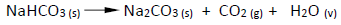
A termólise de 84 g do reagente produzirá a massa de carbonato de sódio e o número de mols de dióxido de carbono iguais a, respectivamente,
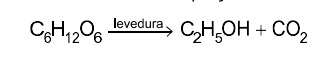
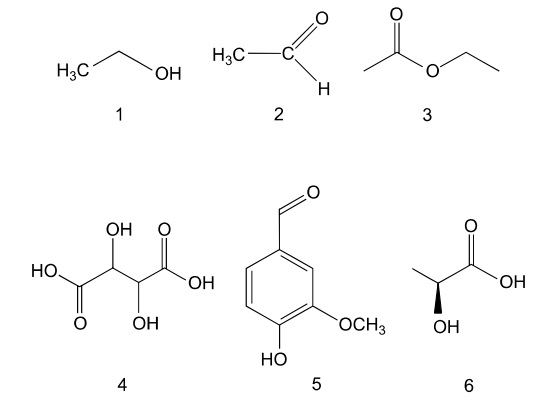
Leia o texto para responder às questões de 13 a 15. A produção de vinhos tem se desenvolvido nas últimas décadas em diversas regiões do Brasil. As características do vinho dependem de vários fatores, como condições de plantio (viticultura), processo de fermentação (vinificação) e compostos químicos participantes nessas etapas. Na viticultura, o óxido de cálcio (CaO) é usado para a correção do pH do solo, e o gesso agrícola ((CaSO4,2H2O é utilizado como fonte de cálcio e enxofre. Na vinificação, as uvas são prensadas e misturadas a leveduras, microrganismos que promovem a fermentação dos açúcares de acordo com a equação não balanceada:
Durante o processo de vinificação, adiciona-se dióxido de enxofre (SO2,) para bloquear a ação de enzimas oxidantes. Alguns compostos orgânicos responsáveis pelo aroma e sabor do vinho estão representados pelas fórmulas estruturais de1 a 6.

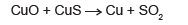
Com base nos conhecimentos sobre cálculos estequiométricos, a massa de cobre obtida quando 159 kg de óxido de cobre reagem completamente com sulfeto de cobre é, aproximadamente,
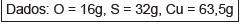
Tabagismo passivo é a inalação da fumaça de derivados do tabaco, tais como cigarro, charuto, cigarrilhas, cachimbo, narguilé e outros produtores de fumaça, por indivíduos não fumantes, que convivem com fumantes em ambientes fechados, respirando as mesmas substâncias tóxicas que o fumante inala.
A fumaça do cigarro é uma mistura de aproximadamente 4.720 substâncias tóxicas diferentes que se constituem de duas fases fundamentais: a particulada e a gasosa. A fase gasosa é composta, entre outros, por monóxido de carbono, amônia, cetonas, formaldeído, acetaldeído, acroleína. A fase particulada contém nicotina e alcatrão. A nicotina é considerada pela OMS uma droga psicoativa que causa dependência. A nicotina age no sistema nervoso central, como a cocaína, com uma diferença: chega em torno de 7 a 19 segundos ao cérebro. Por isso, o tabagismo é classificado como doença e está inserido no Código Internacional de Doenças (CID-10) no grupo de transtornos mentais e de comportamento devido ao uso de substância psicoativa. Em 2011, houve um grande avanço que tem contribuído para que não haja mais a poluição tabagística ambiental nos recintos fechados. Houve a aprovação da Lei nº 12.546, de 14 de dezembro, que proíbe o fumo em local fechado em todo País. (TABAGISMO, 2019).
Na metalurgia, o cromo metálico pode ser obtido pela reação de seu óxido com alumínio, de acordo com a equação abaixo.
2 Al(s) + Cr2O3(s) → Al2O3(s) + 2 Cr(s)
Considerando as massas iniciais de 108 g de Al, 400 g de Cr2O3 e o rendimento da reação de 80%, a massa, em gramas de Cr, obtida é
Dados
MAl = 27 g mol-1
MCr2O3 = 152 g mol L-1
MCr = 52 g mol-1
H2SO4 + 2NaHCO3 → Na2SO4 + 2H2O + 2CO2
A massa de bicarbonato de sódio necessária para a neutralização completa do ácido sulfúrico contido nessa solução é igual a
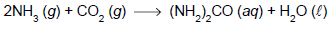
Em uma reação de formação da ureia, com 100% de rendimento, foram empregados 68 kg de amoníaco e 110 kg de gás carbônico.
A quantidade máxima de ureia formada nessas condições e o reagente em excesso são
Considere a equação da reação de combustão incompleta do gás butano:

A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de


KO2(s) + CO2(g) → K2CO3(s) + O2(g)
Ajustando-se à equação química, é correto afirmar que a quantidade de gás oxigênio produzido quando se usa 852g de superóxido de potássio é
NaCl(aq) + NH3(g) + CO2(g) + H2O(l) -> NaHCO3(s) + NH4Cl(aq) e 2 NaHCO3(s) -> Na2CO3(s) + CO2(g) + H2O(l)
Sendo assim, é correto dizer que a massa de carbonato de sódio produzida a partir de 23,4 g de cloreto de sódio é