Questões de Vestibular
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 151 questões
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar. Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1: sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados:
Um canudo de plástico e outro de vidro borossilicato possuem mesmo volume e densidades de 0,90 g/cm3 e 2,25 g/cm3 , respectivamente.
A razão entre as massas do canudo de plástico e do canudo de vidro corresponde a:
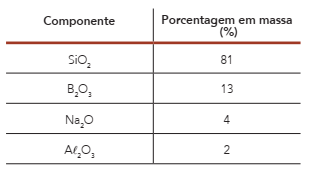
A tabela abaixo apresenta a composição química de uma amostra de 500 g de vidro borossilicato.
Em seu ciclo, um átomo de carbono pode ser incorporado a diferentes compostos por meio de processos contínuos de decomposição e formação de novas moléculas. Os átomos de carbono deste caderno de prova, por exemplo, serão degradados ao longo do tempo e, posteriormente, incorporados a outros seres vivos.
Considere que, ao se degradarem, os átomos de carbono deste caderno se distribuam igualmente entre os 7,5 bilhões de habitantes do planeta.
Sabendo que o caderno possui 90 g de massa, com 45% de carbono em sua composição, o número de átomos que será incorporado em cada habitante é igual a:
O sulfeto de níquel (II), NiS, ocorre na natureza como um mineral relativamente raro, a millerita. Uma de suas ocorrências é em meteoritos. Para se determinar a quantia de NiS em uma amostra do mineral, ela é tratada com ácido nítrico para liberar o níquel.
NiS(s) + 4HNO3(aq) → Ni(NO3)2(aq) + S(s) + 2NO2(g) + 2H2O(l)
A solução aquosa de Ni(NO3)2 é então tratada com o composto orgânico dimetilglioxima (C4H8N2O2 – DMG) para formar o sólido vermelho Ni(C4 H7N2O2 )2(s) de acordo com a reação:
Ni(NO3 )2(aq) + 2 C4 H8 N2 O2(aq) → Ni(C4 H7 N2 O2 ) 2(s) + 2 HNO3(aq
Se uma amostra de 0.468 g contendo millerita
produz 0.206 g do sólido vermelho Ni(C4
H7
N2
O2
)2(s) , a
porcentagem de NiS na amostra é:
Na produção de sabão, uma amostra de 100 g de hidróxido de sódio reage com a estearina, de acordo com a reação não balanceada a seguir:
(C17H35COO)3C3 H5(s) + NaOH(aq) → C17H35COONa(s) + C3H5 (OH)3( l )
Considerando que, a partir de 100 g de hidróxido de
sódio, foram obtidos 512 g de estearato de sódio, o rendimento
deste procedimento é aproximadamente igual a
Um volume de 16.42 mL de uma solução de permanganato de potássio 0.1327 M é necessário para oxidar 20.00 mL de uma solução de FeSO4 em meio ácido.
Considere que a equação não balanceada representativa da reação é:
Fe2+ + MnO4 − + H+ → Mn2+ + Fe3+ + H2O
A concentração da solução do sal de ferro será
aproximadamente:
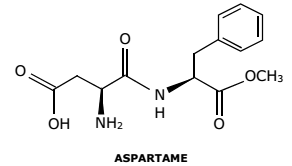
A metilona – um derivado das anfetaminas – produz efeitos semelhantes aos do ecstasy (MDMA), sendo, portanto, um estimulante gerador de euforia e de mais energia e capaz, também, de alterar a percepção sensorial.
Observe a fórmula estrutural da metilona, apresentada a seguir.
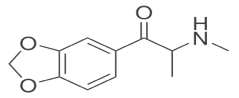
A metilona possui:
Dados de massas molares em g∙mol-1: sulfato de cobre (II) pentaidratado = 250; hidróxido de cálcio = 74.
Bicarbonato de sódio sólido aquecido se decompõe, produzindo carbonato de sódio sólido, além de água e dióxido de carbono gasosos. O gráfico mostra os resultados de um experimento em que foram determinadas as massas de carbonato de sódio obtidas pela decomposição de diferentes massas de bicarbonato de sódio.
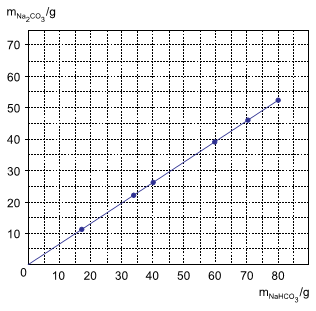
Os dados do gráfico permitem concluir que as massas de
carbonato de sódio e bicarbonato de sódio nessa reação
estão relacionadas pela equação 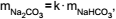 e
que o valor aproximado de k é
e
que o valor aproximado de k é
A hemoglobina é uma proteína de elevada massa molar, responsável pelo transporte de oxigênio na corrente sanguínea. Esse transporte pode ser representado pela equação química abaixo, em que HB corresponde à hemoglobina.
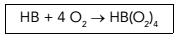
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
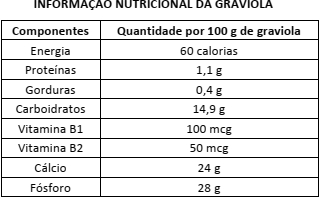
Disponível em:<http://www.tuasaude.com/beneficios-da-graviola/>.
Acesso em: 28 de julho de 2016.
De acordo com os dados apresentados nessa tabela, depreende-se que, em uma tonelada de graviola, existe(m)
Dados: M (Ca) = 40 g/mol; N.A. = 6,0 x 1023 mol–1
M (P) = 31 g/mol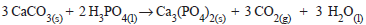
INSTRUÇÃO: Para responder à questão, analise o texto e a estrutura a seguir.
Uma das preocupações do Comitê Olímpico Internacional é combater o doping de atletas nas Olimpíadas. Para isso, uma série de análises é realizada rotineiramente com amostras de urina colhidas dos atletas. Nessas análises, uma das substâncias pesquisadas é o THG, que é um esteroide anabolizante. Os métodos de análise são extremamente sensíveis, sendo possível detectar THG em uma concentração tão baixa como 1 ppb (uma parte por bilhão). Isso significa uma concentração em que há um bilionésimo de grama de THG para cada grama de amostra.
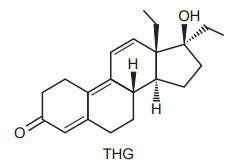
De acordo com as informações acima, assinale a
alternativa correta.
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
O mercúrio é um metal prateado que, em temperatura ambiente, é líquido e inodoro. Quando a temperatura é aumentada, transforma-se em vapor tóxico e corrosivo. Trata-se de produto perigoso à saúde quando inalado, ingerido ou em contato, causando irritação na pele, olhos e vias respiratórias. Uma forma de obtenção de mercúrio se dá por ustulação do sulfeto de mercúrio II (ou cinábrio) segundo a reação:
HgS + O2 → Hg + SO2
Sabendo-se que o sulfeto de mercúrio II possui 70 % de pureza, a massa de mercúrio produzida pela ustulação de uma tonelada do composto é





