Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
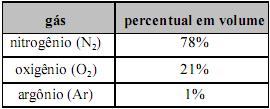
Considere que o ar atmosférico seja uma mistura de gases e tenha a composição mostrada na tabela abaixo. Sabendo-se que a massa molar aparente desse ar é a média ponderada que relaciona a fração em volume de cada componente com a sua respectiva massa molar e assumindo-se a constante universal dos gases R = 0,082 atm·L/KAmol, é correto afirmar que, a 1 atm e a 0 ºC, a densidade aparente desse ar é superior a 1,25 g/L.
Questão Discursiva
Em um frasco de 1,0 L, foram colocados, a determinada temperatura, 0,880 g de N2O e 1,760 g de O2 gasosos, para reagir. Após se estabelecer o equilíbrio químico, foi formado 1,012 g de gás NO2. Considerando essas condições, calcule a concentração molar de equilíbrio do O2 e multiplique o resultado por 104 . Para marcação no Caderno de Respostas, despreze, caso exista, a parte fracionária do resultado obtido, após ter efetuado todos os cálculos solicitados.
R:385
O percentual em massa de nitrogênio presente em todo o explosivo usado para demolir a arquibancada do estádio Mané Garrincha foi de
Considerando-se o rendimento de 100% para a reação de combustão do nitrato de amônio, é correto afirmar que a quantidade de explosivo utilizada na referida demolição da arquibancada do estádio Mané Garrincha produziu mais de 9,0 × 105 kJ de energia.
30 60
50 70
Para dissolver 40 g desse sal à 50 °C e 30 °C, as massas de água necessárias, respectivamente, são:


