Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
Considerando-se a Lei da Conservação da Massa e o processo envolvido, aponte a alternativa correta.
Cu2CO3(OH)2 + 8SiO2 + 2CaCO3 → 2CaCuSi4O10 + 3CO2 + H2O
Em um experimento, foram misturados 221 gramas de Cu2CO3(OH)2, 600 gramas de SiO2 e 1000 gramas de CaCO3.
Considerando as informações fornecidas e que a massa molar (g mol–1) de Cu2CO3(OH)2 é 221, a de SiO2(s) é 60, a de CaCO3 é 100 e a de CaCuSi4O10 é 376, qual será a massa de pigmento azul egípcio obtida, em gramas?
Na produção de aço, é crucial garantir que a matéria-prima utilizada (minério de ferro) contenha a quantidade correta de ferro. A presença de impurezas ou variações na concentração de ferro pode afetar significativamente as propriedades mecânicas do aço, como sua resistência e durabilidade. Para determinar o conteúdo de ferro na amostra do minério de ferro, é necessário dissolver o material em ácido sulfúrico (H2 SO4 ) para converter todo o ferro presente em íons Fe²⁺. O ferro, então, é titulado com uma solução de Ce4+ de concentração conhecida. As equações de semirreação de redução e a imagem a seguir servem para ilustrar esse procedimento de titulação.


Portanto, considere o contexto desse experimento para responder à seguinte questão: Qual dos seguintes processos ocorre durante a titulação representada na imagem?
DADOS QUE PODEM SER USADOS NESTA PROVA

No que diz respeito à pressão do gás, é correto afirmar que
Dado: massa molar do HCl = 36,5 g/mol.
H2PO3F(aq) + 2 NaOH(aq) → Na2PO3F(aq) + 2 H2O(l)
Adicionou-se uma solução de NaOH 0,14 mol L-1 ao ácido até ser obtido 0,28 mol de Na2PO3F. Qual foi o volume da solução de NaOH adicionado?
DADOS QUE PODEM SER USADOS

DADOS QUE PODEM SER USADOS

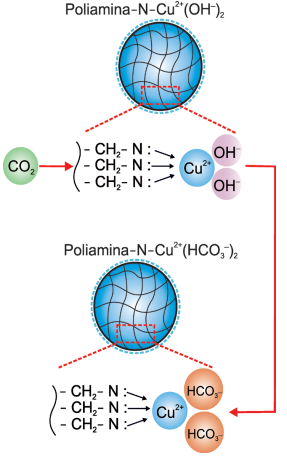
De acordo com os autores do estudo, 1 kg de poliamina contendo cobre é capaz de adsorver até 5 mols de CO2 , uma quantidade bem superior ao que se conhece até então. Com base nessas informações, pode-se concluir que a porcentagem em massa de cobre no sólido é cerca de
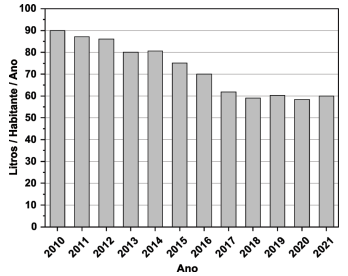
Dados:
i) ingestão total de energia diária para adultos: 8400 kJ (recomendação da OMS).
ii) energia por grama de açúcar: 16,5 kJ.
De acordo com as informações do gráfico e do texto 1, pode-se afirmar que a média de consumo diário de açúcar, por habitante, para cada ano, devido somente à ingestão de refrigerante,
CH4(g) + 3 Cl2(g) → CHCl3(l) + 3 HCl(g)
A quantidade de cloro, em gramas, necessária para produzir 1,5 mol de clorofórmio é
PO4 3− + 12MoO4 2− + 27H+ → H3PMo12O40 + 12H2O
Nesse teste, a quantidade de matéria de MoO4 2− necessária para uma amostra de 10 mL contendo 2 mg L−1 de H3PO4 (98 g mol−1) é mais próxima de:
Dados: 1 mg = 10−3 g; 1 mL = 10−3 L

BRANDÃO, H. N., DAVID, J. P., COUTO, R. D., NASCIMENTO, J. A. P., DAVID, J. M. Quím. Nova, Vol. 33 (6), 1359-1369, 2010.
Tendo como base um caso hipotético para o Paclitaxel que envolva duas etapas reacionais, conforme a ilustração dada, e partindo-se de 1 mol de reagentes na etapa reacional 1, ao final de todo o processo de síntese do Paclitaxel, quantos gramas desse composto seriam sintetizados?

Dados: C = 12 g/mol; H = 1 g/mol; N = 14 g/mol; Cl = 35,5 g/mol; O = 16 g/mol; P = 31 g/mol
Considerando a reação de formação do glifosato, quais as quantidades de ácido clorometilfosfônico e de glicina são necessárias para preparar 1 tonelada do produto, respectivamente? (método obtido da United States Patent Office Patents n. 3,799,7258-1974).
A produção mundial de ácido cítrico é de aproximadamente 63,5 milhões de quilogramas por ano, sendo esse ácido orgânico produzido pela fermentação aeróbica da sacarose (C12H22O11) por uma cultura pura do fungo filamentoso Aspergillus niger, de acordo com a reação global representada a seguir.
C12H22O11 + 3 O2 → 2 C6H8O7 + 3 H2O
Considerando as informações anteriores, julgue o item.
Para produzir 63,5 milhões de quilogramas de ácido cítrico, a quantidade de sacarose necessária será
igual ou superior a 50 milhões de quilogramas e inferior
a 60 milhões de quilogramas.