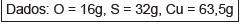Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 614 questões
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
Dados: 1.000 gramas de etanol combustível apresentam 940 g de etanol e 60 g de água; massas molares (g mol-1): C2H6O = 46; CO2 = 44.
Um paciente, com recomendação médica para lúpus eritematoso, fez uso da hidroxicloroquina, ingerindo uma dose diária de 400 mg durante 4 semanas.
Afórmula deste composto é dada a seguir.
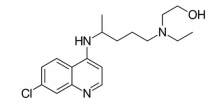
A quantidade de matéria , em mol, de hidroxicloroquina, ingerida pelo paciente ao longo das 4 semanas de tratamento foi de:
(Dado: massa molar da hidroxicloroquina = 335,5
g/mol)
3 Mn3O4 + 8 Al -> 9 Mn + 4 Al2O3
Em uma operação industrial, reagiu-se 13740 kg de Mn3O4 e 6480 kg de Al. Admitindo-se o consumo do reagente limitante por completo, a massa de Mn formado, em quilogramas, é igual a:
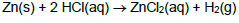
Se 10,00 g de Zn foram misturados com 8,00 g de ácido clorídrico, quantos mols de H2 foram liberados aproximadamente:
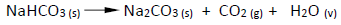
A termólise de 84 g do reagente produzirá a massa de carbonato de sódio e o número de mols de dióxido de carbono iguais a, respectivamente,
Dados: Volume Molar (CATP) = 25 L; d(C8H18) = 800 g/L; Massas Molares – H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Al + Fe2O3 → Fe + Al2O3
Dados: Massas Molares – O = 16 g/mol; Al = 27 g/mol; Fe = 56 g/mol
Segundo o site saúde.gov.br, diabetes é uma doença causada pela produção insuficiente ou má absorção de insulina, hormônio que regula a glicose no sangue e garante energia para o organismo. Para evitar que as células parem de funcionar, o organismo passa a usar os estoques de gordura para gerar energia. Só que nesse processo em que o corpo usa a gordura como energia, formam-se as cetonas. A equação química para a última etapa deste processo é a seguinte:
H3CCOCH2CO2H → H3CCOCH3 + CO2
A quantidade de acetona, produzida, em valores aproximados, que pode ser produzida a partir de 125 mg do ácido acetoacético, será:
Dados: massa molar (g/mol) C = 12; O = 16; Constante de Avogadro = 6.10 23 mol–1 C + O2 → CO2
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
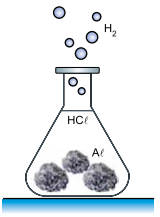
A equação que representa essa reação é:
Aℓ (s) + 3HCl (aq) → AℓCℓ3 (aq) + 3/2H2 (g)
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m3 . Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
DADOS QUE PODEM SER USADOS NESTA QUESTÃO

DADOS QUE PODEM SER USADOS NESTA QUESTÃO

4Fe(s) + 4NaCℓO3(s) → 2Fe2O3(s) + 4NaCℓ(s) + 3O2(g) + calor.
A proporção adequada entre as massas dos dois reagentes para que a reação ocorra sem sobra de nenhum deles é
Duzentos gramas de carbonato de cálcio reagem com 96g de dióxido de enxofre produzindo sulfito de cálcio e dióxido de carbono. Assinale a alternativa que contém, respectivamente, a massa de sulfito de cálcio e o volume de dióxido de carbono, produzidos (nas CNTP) nessa reação.
Dados: Ca: 40 g/mol; S; 32 g/mol; O: 16 g/mol; C: 12 g/mol.
CARGUEIRO COM 2400 TONELADAS DE ÁCIDO
SULFÚRICO VIROU NO RIO RENO
Um cargueiro com 2400 toneladas de ácido sulfúrico virou-se [...] no rio Reno, ao passar pela Alemanha. Dois membros da tripulação estão dados como desaparecidos. [...]
Disponível em: http://www.publico.pt/ciencia/noticia/cargueiro-com-2400-- toneladas-de-acido-sulfurico-virouse-no-rio-reno-1475034. Acesso em: 15 de agosto de 2015.
[Dados: M(H2SO4) = 98 g/mol; M[Ca(OH)2] = 74 g/mol; N.A. = 6,0 ˑ 1023]
Supondo que toda a massa fornecida seja só de ácido sulfúrico, pode-se inferir que
Considere a reação abaixo (não balanceada):
NH3 + O2 ➔ NO + H2O
O número de moléculas de NO formadas na reação da amônia (NH3) com 2,0 .1021 moléculas de oxigênio será:
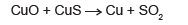
Com base nos conhecimentos sobre cálculos estequiométricos, a massa de cobre obtida quando 159 kg de óxido de cobre reagem completamente com sulfeto de cobre é, aproximadamente,