Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
3 mols de ácido reagem com 12,04 x 1023 moléculas de base.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Al(OH)3(aq) + 3/2 H2SO4(aq) ===> 1/2 Al2(SO4)3(s) + x H2O(l)
Ao se reagir 156 g da base, irá se formar 342 g do sal.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Os calcogênios possuem maior densidade (ou densidade absoluta) do que os halogênios.
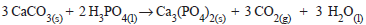
Considerando um tanque de combustível de 55 L, em que o automóvel A foi abastecido com álcool e o automóvel B com gasolina, qual o volume aproximado em L de gás carbônico, nas condições normais de temperatura e pressão, que será emitido pelos automóveis, respectivamente?
Considerar: - Volume molar dos gases nas CNTP, Vm= 22,7 L - densidade do etanol = 0,8 g.mL-1 - densidade do iso-octano = 0,7 g.mL-1
Na reação de oxidação de um composto orgânico X, foi consumido 128 g de oxigênio, com produção de 132 g de gás carbônico e 54,06 g de água, conforme reação abaixo. O composto orgânico X e os coeficientes estequiométricos para os produtos seriam, respectivamente,
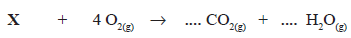
Uma quantidade igual a 5 g de NaCl é dissolvida em
25 g de água. A fração molar em quantidade de matéria
do NaCl na solução é aproximadamente igual a
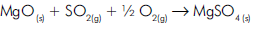
Quantas toneladas de óxido de magnésio são consumidas no tratamento de 9,6 x 103 toneladas de SO2 ?
CS2(l) + 3O2(g) ➡︎ CO2(g) + 2SO2(g)
Al + H2SO4 ⇌ Al2(SO4)3 + H2
Um analista utilizou uma quantidade suficiente de H2SO4 para reagir com 5,4g do metal e obteve 5,71 litros do gás nas CNTP. Nesse processo, o analista obteve um rendimento aproximado de: Dados: Al = 27
2KI(aq) + Pb(NO3)2(aq) ↠ PbI2(s) + 2 KNO3(aq)
O iodeto de chumbo II produzido tem massa, aproximadamente, igual a: