Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
DADOS QUE PODEM SER USADOS NESTA QUESTÃO

DADOS QUE PODEM SER USADOS NESTA QUESTÃO

4Fe(s) + 4NaCℓO3(s) → 2Fe2O3(s) + 4NaCℓ(s) + 3O2(g) + calor.
A proporção adequada entre as massas dos dois reagentes para que a reação ocorra sem sobra de nenhum deles é
TEXTO 01
E se fosse possível captar CO2 da atmosfera para criar combustível?
Uma das principais preocupações na atualidade é a questão ambiental; todos sabem que os diversos poluentes emitidos diariamente são prejudiciais para nosso planeta, e nem sempre há alternativas acessíveis para controlá-los. Mas e se soluções simples pudessem ser usadas - por exemplo, capturar gás carbônico diretamente da atmosfera e transformá-lo em combustível?
(Disponível em:< https://www.tecmundo.com.br/ciencia/131145-fosse-possivel-captar-co2-atmosfera-criar- combustivel.htm. >Acesso em:10/08/2018.)
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
O dióxido de enxofre (SO2), produto da combustão do carvão em centrais termoelétricas, é o mais importante precursor da chuva ácida, ocasionando impacto nas florestas, pastos, lavouras, ambientes aquáticos e afetando o solo. Uma tecnologia de dessulfurização de gás de chaminé, para limitar a emissão de SO2, utiliza o CaCO3 como adsorvente deste gás e gera o gesso (sulfato de cálcio). Segundo dados do IPCC2006 (Intergovernmental Panel on Climate Change), no mundo, aproximadamente 1012 g de SO2 deixam de ser emitidos por ano devido à utilização de tecnologias de dessulfurização dos gases de exaustão após combustão do carvão. Considerando que toda tecnologia de dessulfurização empregue carbonato de cálcio, a massa de gesso produzida em um ano, a partir do consumo de 1012 g de SO2 , com rendimento de 100%, de acordo com a equação química a seguir, é de aproximadamente
2 CaCO3(s) + 2 SO2(g) + O2(g) → 2 CaSO4(g) + 2 CO2(g)
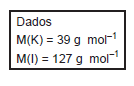
SiO2(s) + C(s) → Si(s) + CO2(g)
Considerando a reação completa, a massa de silício, em gramas, formada pela reação de 24.000 g de SiO2 com excesso de carbono é





SiO2(s) + C(s) → Si(s) + CO2(g)
Considerando a reação completa, a massa de silício, em gramas, formada pela reação de 24.000 g de SiO2 com excesso de carbono é
Dados M(Si): 28 g mol-1 M(O): 16 g mol-1
Disponível em: <sistemas.eel.usp.br/docentes/arquivos/5840556/434/apostila4papelecelulose.pdf> e <portalresiduossolidos.com/reciclagemde-papel-2/>. Acesso em: 15 out. 2018. [Adaptado].
Sobre esse assunto é correto afirmar que
Uma forma de reduzir a poluição atmosférica provocada pelo
gás dióxido de enxofre (SO2
), produzido em certas atividades
industriais, é realizar a lavagem dos gases de exaustão com
uma suspensão aquosa de cal hidratada [Ca(OH)2
]. Com
isso, ocorre uma reação química em que se formam sulfito de
cálcio (CaSO3) sólido e água (H2O) líquida, evitando a emissão do poluente para o ar.
Considerando que o volume molar de gás nas Condições Ambiente de Temperatura e Pressão (CATP) é igual a 25 L/mol, para cada 1,2 kg de sulfito de cálcio formado, o volume de dióxido de enxofre, medido nessas condições, que deixa de ser emitido para a atmosfera é de
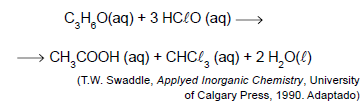
Considerando-se o tratamento de 1 m3 de água contaminada com acetona na concentração 5,8 mg/L, a quantidade máxima, em mol, de ácido hipocloroso que poderá ser consumida na reação com a acetona é igual a
Questão

3NaHCO3(aq) + H3C6H5O7(aq) → 3CO2(g) + 3H2O(l) + Na3C6H5O7(aq)
Considerando-se essa informação associada aos conhecimentos sobre estequiometria e propriedades das substâncias químicas envolvidas na reação, é correto afirmar:
Dado: massa molecular do metano = 16 g.mol-1.
w Ca3(PO4)2(aq) + x H2SO4(aq) → y H3PO4(aq) + z Ca(SO4)(aq)
Se utilizarmos 50 g de Ca3(PO4)2 e ácido sulfúrico em excesso, quantos gramas de ácido fosfórico podem ser obtidos através dessa reação?
Dados: massas moleculares em g.mol-1 : Ca3(PO4)2 = 310; H3PO4 = 98.
O gás butano (C4 H10) é um combustível não renovável derivado do petróleo, cuja combustão incompleta ocorre quando a quantidade de oxigênio é insuficiente para que ocorra a combustão completa.
Considere a equação da reação de combustão incompleta do gás butano:
2C4 H10 (g) + 9O2 (g) 8CO (g) + 10H2 O (g)
A massa do gás monóxido de carbono (massa molar = 28 g/mol) formada quando 522 kg de gás butano (massa molar = 58 g/mol) sofrem combustão incompleta, numa reação com rendimento total, é de

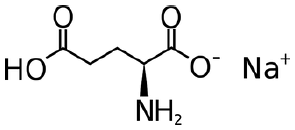
Se 0,1 g de glutamato monossódico for adicionado em um produto alimentício, a massa em miligramas de sódio proveniente desse sal será, aproximadamente:
