Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 614 questões
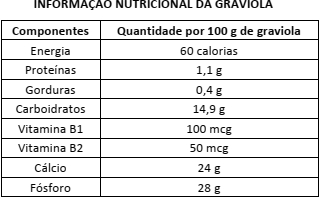
Disponível em:<http://www.tuasaude.com/beneficios-da-graviola/>.
Acesso em: 28 de julho de 2016.
De acordo com os dados apresentados nessa tabela, depreende-se que, em uma tonelada de graviola, existe(m)
Dados: M (Ca) = 40 g/mol; N.A. = 6,0 x 1023 mol–1
M (P) = 31 g/molTEXTO 01
E se fosse possível captar CO2 da atmosfera para criar combustível?
Uma das principais preocupações na atualidade é a questão ambiental; todos sabem que os diversos poluentes emitidos diariamente são prejudiciais para nosso planeta, e nem sempre há alternativas acessíveis para controlá-los. Mas e se soluções simples pudessem ser usadas - por exemplo, capturar gás carbônico diretamente da atmosfera e transformá-lo em combustível?
(Disponível em:< https://www.tecmundo.com.br/ciencia/131145-fosse-possivel-captar-co2-atmosfera-criar- combustivel.htm. >Acesso em:10/08/2018.)
Tabagismo passivo é a inalação da fumaça de derivados do tabaco, tais como cigarro, charuto, cigarrilhas, cachimbo, narguilé e outros produtores de fumaça, por indivíduos não fumantes, que convivem com fumantes em ambientes fechados, respirando as mesmas substâncias tóxicas que o fumante inala.
A fumaça do cigarro é uma mistura de aproximadamente 4.720 substâncias tóxicas diferentes que se constituem de duas fases fundamentais: a particulada e a gasosa. A fase gasosa é composta, entre outros, por monóxido de carbono, amônia, cetonas, formaldeído, acetaldeído, acroleína. A fase particulada contém nicotina e alcatrão. A nicotina é considerada pela OMS uma droga psicoativa que causa dependência. A nicotina age no sistema nervoso central, como a cocaína, com uma diferença: chega em torno de 7 a 19 segundos ao cérebro. Por isso, o tabagismo é classificado como doença e está inserido no Código Internacional de Doenças (CID-10) no grupo de transtornos mentais e de comportamento devido ao uso de substância psicoativa. Em 2011, houve um grande avanço que tem contribuído para que não haja mais a poluição tabagística ambiental nos recintos fechados. Houve a aprovação da Lei nº 12.546, de 14 de dezembro, que proíbe o fumo em local fechado em todo País. (TABAGISMO, 2019).
Para que o airbag de um carro possa inflar, pode ser utilizada a decomposição da azida de sódio, de acordo com a equação química não balanceada. Suponha que um airbag utilize 65 gramas de azida de sódio no processo de inflagem.
NaN3 (s) → Na (s) + N2 (g)
Considere os dados:
Massas molares: Na = 23 g/mol; N = 14 g/mol
Volume molar: 22,4 L
Nessas condições, quantos litros do gás serão formados nesse processo?
Fe2O3 + C →Fe + CO
(Dados: Massa molar do Fe2O3 = 160 g/mol; Massa molar do Fe = 56 g/mol) Quantos quilogramas de hematita são necessários para produzir 560 kg de Fe?
Supondo que 1 mol de NaOH reage com 1 mol de HCl e, levando-se em consideração a lei de conservação das massas de Lavoisier, quantos gramas de H2O seriam produzidos nesta reação?
O balanceamento de equações químicas de oxirredução constitui ferramenta de grande utilidade na Química. O principal fundamento da técnica de balanceamento é o princípio de igualdade entre elétrons cedidos e recebidos, durante o processo de reação química. Considerando-se essas informações e a aplicação do princípio de balanceamento de equação química, com os menores coeficientes estequiométricos inteiros, é correto afirmar:
Considerando-se essas informações e com base nos conhecimentos sobre os conceitos de massa atômica, massa molecular e mol, é correto afirmar:
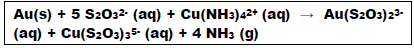
Analise as afirmativas em relação às informações:
I. Na reação demonstrada, o ouro é o agente redutor e o tiossulfato o agente oxidante.
II. É possível afirmar que são descartados anualmente 12 mil toneladas de ouro no lixo eletrônico.
III. A massa de material não metálico descartado anualmente é 1.000 vezes superior à massa de ouro descartada no mesmo período.
IV. Um volume de 14 milhões de metros cúbicos (m3 ) de materiais não metálicos são descartados anualmente no lixo eletrônico.
V. Seriam necessários 6,82 mil toneladas de tiossulfato para tratar a massa de ouro descartada no lixo eletrônico.
Assinale a alternativa CORRETA.
O dióxido de enxofre (SO2), produto da combustão do carvão em centrais termoelétricas, é o mais importante precursor da chuva ácida, ocasionando impacto nas florestas, pastos, lavouras, ambientes aquáticos e afetando o solo. Uma tecnologia de dessulfurização de gás de chaminé, para limitar a emissão de SO2, utiliza o CaCO3 como adsorvente deste gás e gera o gesso (sulfato de cálcio). Segundo dados do IPCC2006 (Intergovernmental Panel on Climate Change), no mundo, aproximadamente 1012 g de SO2 deixam de ser emitidos por ano devido à utilização de tecnologias de dessulfurização dos gases de exaustão após combustão do carvão. Considerando que toda tecnologia de dessulfurização empregue carbonato de cálcio, a massa de gesso produzida em um ano, a partir do consumo de 1012 g de SO2 , com rendimento de 100%, de acordo com a equação química a seguir, é de aproximadamente
2 CaCO3(s) + 2 SO2(g) + O2(g) → 2 CaSO4(g) + 2 CO2(g)
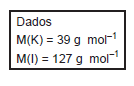
INSTRUÇÃO: Para responder à questão, analise a representação do glifosato a seguir.
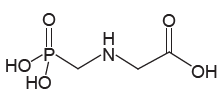
O uso de agrotóxicos é objeto de preocupações, pois o contato com doses elevadas no momento da aplicação tem causado sérios problemas de saúde a trabalhadores rurais. Esse problema se agrava quando os agricultores aplicam doses maiores do que as recomendadas, em uma tentativa de controlar pragas resistentes. O glifosato, por exemplo, no uso agrícola comum, é adquirido como uma solução com a concentração de 360 gramas por litro, sendo aplicados cinco litros por hectare (um hectare equivale a 10000 m²).
Sobre esse assunto, fazem-se as seguintes afirmativas.
I. Em uma aplicação de glifosato, cada hectare de lavoura recebe mais de 1,0×1023 moléculas desse herbicida.
II. Em uma molécula de glifosato há mais átomos de hidrogênio do que de oxigênio.
III. A concentração de glifosato na solução é de aproximadamente 2,1 mol/L.
Está/Estão correta(s) a(s) afirmativa(s)
NaN3 (s) → Na(s) + N2(g)
Analisando o texto, assinale a alternativa CORRETA.
Nas mesmas condições de pressão e temperatura, 50 L de gás propano (C3H8) e 250 L de ar foram colocados em um reator, ao qual foi fornecida energia apenas suficiente para iniciar a reação de combustão. Após algum tempo, não mais se observou a liberação de calor, o que indicou que a reação haviase encerrado. Com base nessas observações experimentais, três afirmações foram feitas:
I. Se tivesse ocorrido apenas combustão incompleta, restaria propano no reator.
II. Para que todo o propano reagisse, considerando a combustão completa, seriam necessários, no mínimo, 750 L de ar.
III. É provável que, nessa combustão, tenha se formado fuligem.
Está correto apenas o que se afirma e
Note e adote:
Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
SiO2(s) + C(s) → Si(s) + CO2(g)
Considerando a reação completa, a massa de silício, em gramas, formada pela reação de 24.000 g de SiO2 com excesso de carbono é






 Na2SiO3(s) + CO2(g)
Na2SiO3(s) + CO2(g)
Dados: M(SiO2) = 60 g mol-1 M(Na2SiO3) = 122 g mol-1
Considerando que o rendimento desse processo foi de 70%, a massa, em kg, de Na2SiO3 formada a partir de 9 kg de sílica foi de aproximadamente
As nanopartículas de prata, usadas em diversas aplicações tecnológicas, podem ser preparadas, em solução aquosa, pela redução de íons Ag+ usando boro-hidreto de sódio (NaBH4), como indicado na equação abaixo:
AgNO3 (aq) + NaBH4 (aq) → Ag (s) + ½ H2 (g) + ½ B2H6 (g) + NaNO3 (aq)
A partir de 100,00 mL de uma solução 2,0 × 10-3 mol L-1 de AgNO3, qual seria a massa mínima de NaBH4 necessária para a reação completa de Ag+ para Ag, expressa em gramas?
Dados:
M(AgNO3) = 170 g mol-1
M(Ag) = 108 g mol-1
M(NaBH4) = 38 g mol-1
Em uma reação entre ácido sulfúrico e hidróxido de sódio, foram misturados 122,5g de ácido sulfúrico e 130g de NaOH. Segue a equação não balanceada:
H2SO4(aq) + NaOH(aq) → Na2SO4(s) + H2O(I)
• Qual o reagente limitante e a massa de NaOH consumida,
respectivamente?
NH2Cl + NH3 → N2H4 + HCl
Assinale a alternativa que apresenta a massa de hidrazina que pode ser obtida pela reação de 10,0 g de cloramina com 10,0 g de amônia.
