Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
Com base no texto anterior e nas informações precedentes e considerando que 1 L = 1 dm3 , julgue o item.
Considerando-se que, por ano, o Brasil exporta um milhão de toneladas de suco de laranja e importa 500.000 t de ácido cítrico, é correto afirmar que, se o ácido cítrico fosse obtido diretamente do suco de laranja em vez de ser exportado, o Brasil, mantida a atual demanda interna por ácido cítrico,
teria de importar entre 100.000 t e 400.000 t de ácido cítrico por ano.
Tem-se como exemplo do colonialismo e biopirataria no Brasil o caso do cupuaçu, fruto amazônico de sabor doce e polpa grossa, que serve como fonte de alimento tanto para as populações indígenas quanto para os animais que vivem na região. O cupuaçu é rico em substâncias importantes para a saúde, como fósforo e vitaminas B1 (tiamina), B2 (riboflavina) e B5 (ácido pantotênico). Após uma empresa estrangeira registrar o nome cupuaçu como a Cupuacu International Inc., todos os produtores brasileiros eram obrigados a pagar royalties a essa empresa, sempre que exportassem produtos à base do fruto amazônico. Graças à repercussão desse caso, as ONGs, junto à opinião pública, conseguiram pressionar o escritório de patentes estrangeiro para cancelar o registro da marca “cupuaçu”.
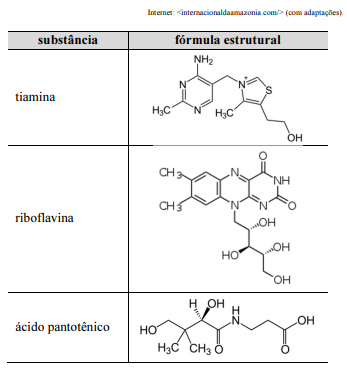
A partir do texto e das fórmulas estruturais mostradas na tabela precedente, julgue o próximo item.
O fósforo presente em uma amostra de 500 g de cupuaçu foi
totalmente extraído e isolado na forma de fosfato de cálcio,
um sólido pouco solúvel que, após seco e pesado, rendeu
625 mg desse sal. Nesse caso, a fração em massa de fósforo
na amostra de cupuaçu é superior a 500 mg/kg.
S(s) + O2(g) → SO2(g)
Nesse caso, a diferença de massa de SO2 emitido para a atmosfera por kg de diesel quando cada um dos dois tipos é queimado é de
Note e adote: Massas molares (g/mol): O = 16; S = 32. 1 ppm de enxofre equivale a 1 mg de enxofre por kg de diesel.
Considerando-se que, no processo de queima da argila, o hidróxido de cálcio se transforme em óxido de cálcio por desidratação, é correto afirmar que a queima de 100 g de hidróxido de cálcio produz menos de 50 g de CaO.
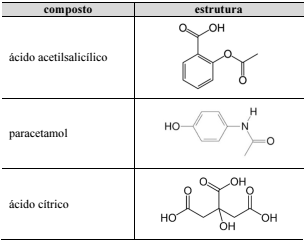
Os compostos orgânicos listados na tabela precedente são amplamente utilizados em medicamentos, entre os quais estão incluídos os efervescentes. Estes resultam da combinação de sólidos misturados e prensados para formar um comprimido contendo o fármaco ácido e um composto básico, como o NaHCO3. Quando o medicamento é colocado na água, a reação entre esses compostos libera CO2, que forma as bolhas na efervescência, como representado para o ácido acetilsalicílico na reação a seguir. Existem, também, vários compostos inorgânicos que são empregados na fabricação de medicamentos, como o FeSO4 e o KMnO4.
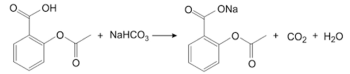
Tendo como referência as informações precedentes, julgue o item.
Se, nas condições em que a reação acontece, o volume
ocupado por 1 mol de qualquer gás é 22,4 L, então a reação
completa de 9 g de ácido acetilsalicílico com um excesso de
NaHCO3 libera mais de 1 L de CO2.
Bicarbonato de sódio é utilizado como medicamento antiácido. Em presença de ácido, esse composto reage de acordo com a equação química a seguir:
NaHCO3 + H+ → Na+ + CO2 + H2O
Na reação completa de 16,8 g de NaHCO3 , a massa, em gramas, de CO2 produzida é igual a:
Dados: massa molecular do NaOH = 40,0 g mol-1; massa molecular do ácido sulfúrico = 98,0 g mol-1; equação da reação: H2SO4+ NaOH → Na2SO4 + H2O (não balanceada).
Com base nessas informações, assinale a alternativa correta quanto à quantidade em mol e mol L-1 de H2SO4 presente nos 5,00 litros de solução.
No contexto da pandemia de covid-19, o antimalárico cloroquina e o vermífugo nitazoxanida têm causado controvérsia quanto à sua eficácia contra o novo coronavírus. As fórmulas estruturais desses dois fármacos são mostradas a seguir.
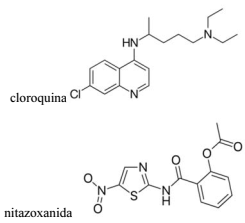
Na combustão completa da cloroquina, em que todo o carbono é convertido a CO2, para cada 100 g de cloroquina queimados, são gerados mais de 200 g de gás carbônico.
Uma amostra de uma rocha de massa 0.250 g, com baixo teor de Cr, foi submetida à fusão com Na2O2 transformando o cromo em cromato (CrO4 = ). A amostra foi dissolvida em água em ebulição, acidificada e o CrO4 = foi convertido a dicromato (Cr2O7 = ). Na sequência, a amostra foi titulada com 27 mL de solução de Fe2+. Os produtos desta reação foram Fe3+ e Cr3+. Numa padronização paralela, 47 mL de Fe2+ foram usados na redução de 0.1172 g de K2Cr2O7. A reação decorrente foi:
Cr2O7 = + 6Fe2+ + 14H+ → 2Cr3+ + 6Fe3+ + 7H2O.
A massa percentual de Cr na amostra é:
O volume em mL (cm3 ) de uma solução de HNO3 de densidade 1.497 g/cm3 , contendo 93.25% por peso de HNO3 puro, necessários para atacar, completamente, uma esfera de cobre com 2.0 cm de diâmetro, é:
Dados: Volume da esfera: V = (4/3)πR3 , π = 3.14, densidade (Cu) = 8.9 g/cm3
Reação que ocorre: Cu + 4HNO3(conc.) → Cu(NO3)2 + 2H2O + 2NO2
DADOS QUE PODEM SER USADOS NESTA PROVA

DADOS QUE PODEM SER USADOS NESTA PROVA

A reação abaixo representa a decomposição deum carbonato onde X é um metal.
XCO3(s) → XO(s) + CO2(g)
Quando utilizamos 1,70 g de XCO3, são produzidos0,88 g de XO. Com base nesta informação e usando cálculos aproximados, é correto dizer que o metal é
Em um processo de produção industrial, ao adicionar 254 kg de I2 e 80 kg de N2 H4 , verifica-se o consumo completo do reagente limitante. A massa de reagente em excesso, que não foi consumida, em quilogramas, tem valor igual a:
Fe2O3(s) + 3 H2S(g) → Fe2S3(s) + 3 H2O(l)
A partir desses dados, pode-se afirmar que, na condição de remoção máxima de sulfeto de hidrogênio relatada no estudo,
Massas molares (g mol-1): Fe = 56, H = 1, O = 16 e S = 32.
Dados: 1.000 gramas de etanol combustível apresentam 940 g de etanol e 60 g de água; massas molares (g mol-1): C2H6O = 46; CO2 = 44.
Dados: Volume Molar (CATP) = 25 L; d(C8H18) = 800 g/L; Massas Molares – H = 1 g/mol; C = 12 g/mol; O = 16 g/mol
Al + Fe2O3 → Fe + Al2O3
Dados: Massas Molares – O = 16 g/mol; Al = 27 g/mol; Fe = 56 g/mol
Segundo o site saúde.gov.br, diabetes é uma doença causada pela produção insuficiente ou má absorção de insulina, hormônio que regula a glicose no sangue e garante energia para o organismo. Para evitar que as células parem de funcionar, o organismo passa a usar os estoques de gordura para gerar energia. Só que nesse processo em que o corpo usa a gordura como energia, formam-se as cetonas. A equação química para a última etapa deste processo é a seguinte:
H3CCOCH2CO2H → H3CCOCH3 + CO2
A quantidade de acetona, produzida, em valores aproximados, que pode ser produzida a partir de 125 mg do ácido acetoacético, será:
Dados: massa molar (g/mol) C = 12; O = 16; Constante de Avogadro = 6.10 23 mol–1 C + O2 → CO2