Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
CS2(l) + 3O2(g) ↠ CO2(g) + 2SO2(g)
Al + H2SO4 ↠ Al2(SO4)3 + H2
Um analista utilizou uma quantidade suficiente de H‚SO„ para reagir com 5,4g do metal e obteve 5,71 litros do gás nas CNTP. Nesse processo, o analista obteve um rendimento aproximado de: Dados: Al = 27
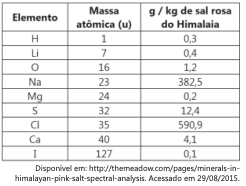
Mesmo que o sal rosa do Himalaia ofereça mais benefícios à saúde, a substituição do sal refinado por ele não contribui significativamente para a diminuição da ingestão do elemento causador da hipertensão, porque, para cada quilograma de sal refinado substituído por sal rosa do himalaia, a massa de sódio seria, aproximadamente:
C12H22O11(s) + O2(g) ⟶ CO2(g) + H2O(l) + energia
Nas condições normais de temperatura e pressão, o volume de CO2 produzido, como resultado da queima de 6,84 g de sacarose, é aproximadamente:

Um airbag é uma bolsa que infla rapidamente e que, num acidente de carro, ajuda a prevenir lesões graves, como mostra a figura ao lado. Quando se produz a desaceleração repentina do carro, é conectado automaticamente um interruptor, que inicia uma reação química, liberando o gás nitrogênio em quantidade suficiente, conforme a equação a seguir:
6 NaN3(l) + Fe2O3(s) 3 Na2O(s) + 2 Fe(s) + 9 N2(g)
Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de NaN3, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
( ) O potencial padrão de redução do alumínio (E° = −1,66V) mostra que ele é facilmente oxidado. ( ) A resistência do alumínio à corrosão deve-se à formação de uma camada fina, dura e transparente de Al2O3 que adere à superfície do metal. ( ) A quantidade de matéria de alumínio necessária para se obter 204g de Al2O3 é 2,5 mols. ( ) O átomo de alumínio possui número atômico 13 e massa 26,98u.
Assinale a seqüência correta.
Considere: • detanol = 0,8g ⋅ cm−3 • N = 6,00 ×1023
Durante décadas, o DDT(dicloro-difenil-tricloroetano) foi largamente usado como inseticida até ser comprovado que, além de provocar câncer, demora de 4 a 30 anos para se degradar. O DDT foi utilizado na Segunda Guerra Mundial para prevenção de tifo em soldados, que o utilizavam também para o combate a piolhos. Posteriormente foi usado na agropecuária, no Brasil e no mundo, dado seu baixo preço e elevada eficiência. Especialistas afirmam que o principal problema do DDT é sua ação indiscriminada, que atinge tanto as pragas quanto o resto da fauna e flora da área afetada. O DDT também se infiltra na água, contaminando os mananciais.

I - 2 NaHCO3
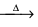 X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y Sobre esse processo, assinale a afirmativa correta.
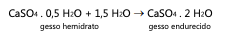
O conhecimento do processo químico de endurecimento do gesso permite avaliar possíveis alterações em sua massa. De fato, a equação química apresentada permite constatar que, após seu preparo, aplicação e endurecimento, o gesso apresenta:
Dados: massas moleculares (g/mol): H = 1, O = 16, S = 32, Ca = 40.
SiO2(s) + 6 HF(aq) → SiF62−(aq) + 2 H3O+ (aq)
Calcule a massa de ácido fluorídrico necessária para reagir com 1,0 kg de SiO2.
Dados: Massas molares em g . mol-1 : H = 1; F = 19; O = 16; Si = 28.

A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é utilizada como fermento químico na produção industrial de bolos, pães e biscoitos. Essa é uma forma rápida de fazer expandir, durante o aquecimento, a massa para o preparo desses alimentos, em relação à utilizada com fermento biológico.
Considerando-se essas informações, é correto afirmar:

O peróxido de hidrogênio, H2O2(l), é um líquido incolor espesso, empregado como antisséptico e alvejante, a depender da concentração. Ao reagir com algumas substâncias, o peróxido de hidrogênio pode atuar como oxidante ou redutor. A equação química não balanceada representa a reação do íon permanganato com o peróxido de hidrogênio.
A partir dessas informações e após o balanceamento dessa
equação química com os menores coeficientes
estequiométricos inteiros, é correto afirmar:
A produção industrial do ácido sulfúrico é realizada a partir do enxofre, extraído de jazidas localizadas normalmente em zonas vulcânicas. O enxofre extraído é queimado ao ar atmosférico produzindo o anidrido sulfuroso (etapa I). Após essa reação, o anidrido sulfuroso é oxidado a anidrido sulfúrico, em alta temperatura e presença de um catalisador adequado (etapa II). Em seguida, o anidrido sulfúrico0 é borbulhado em água, formando o ácido sulfúrico (etapa III). As reações referentes a cada uma das etapas do processo encontram-se abaixo equacionadas:
Etapa I. S(s) + O2(g) → SO2(g)
Etapa II. 2 SO2(g) + O2(g) → 2 SO3(g)
Etapa III. SO3(g) + H2O(l) → H2 SO4(l)
Desse modo, ao serem extraídos 200,0 kg de enxofre com 80% de pureza de uma jazida, considerando-se que o rendimento global do processo seja de 90%, a massa máxima de ácido sulfúrico que pode ser produzida será de
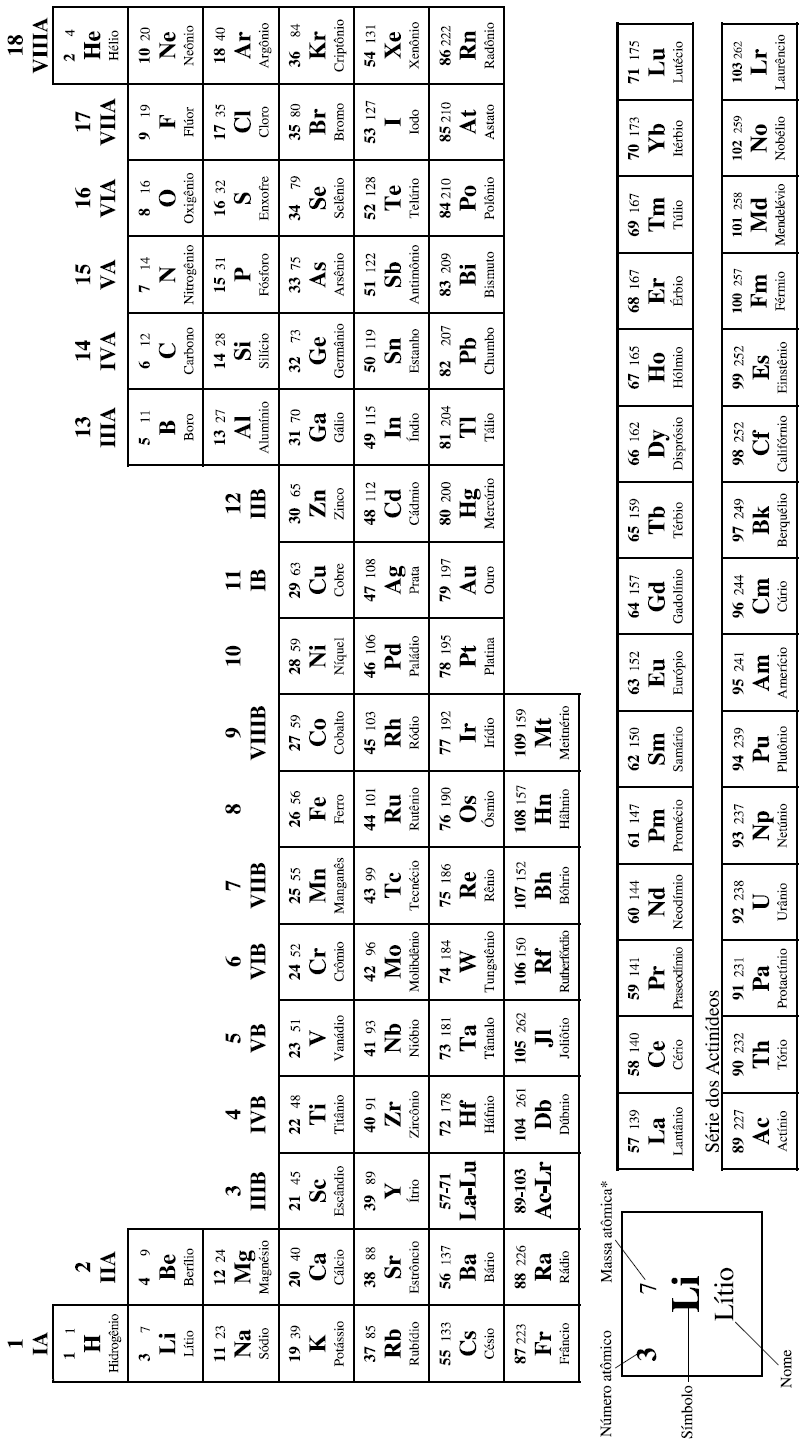
Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.

Um disco circular feito de alumínio de alta pureza, com 20,0 cm de raio, espessura de 2,0 mm e massa de 675,0 g, gira em torno de um eixo fixo em seu centro, descrevendo ângulos de 30º a cada 2,0 segundos.
Dados:
Considerando o exposto, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

Observe atentamente o quadro a seguir, cujos valores de temperatura de ebulição foram medidos sob pressão de 1,0 atm.