Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
Tabela 1: Composição química de uma água mineral
Composição química mg/L
Bicarbonato 82,7 Cálcio 16,0 Cloreto 1,1 Fluoreto 0,1 Magnésio 0,2 Potássio 0,3 Sódio 15,2
Dados: C=12; H=1; F=19; O=16 e P=31
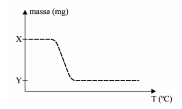
Se a diferença entre as massas X e Y no gráfico for 576 mg, o valor de Y e a porcentagem de perda da massa da reação de decomposição térmica do oxalato de magnésio são, respectivamente,
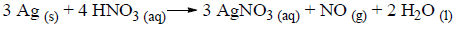
Calcule o volume de NO obtido a 27o C e 1 atm, a partir do consumo de 54 mg de prata. Dado: Ag = 108 g/mol.
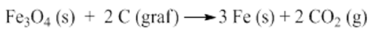
Sabendo que este processo tem um rendimento global de 85%, calcule a massa aproximada de magnetita que precisa ser reduzida para que se obtenha 42 toneladas de ferro. Considere as seguintes massas molares: C = 12 g/mol; O = 16 g/mol; Fe = 56 g/mol.
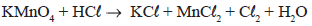
Ao reagir 158g de KMnO4 com quantidade suficiente de HCl, qual o volume aproximado de Cl2 nas condições normais de temperatura e pressão considerando um rendimento de 80%? Considere: Volume molar dos gases nas CNTP = 22,7L
I. Trata-se de um processo endotérmico.
II. Ocorre com liberação de energia para o meio externo.
III. Há a formação de 3 mols de dióxido de carbono e 4 mols de água.
IV. São consumidos 5 mols de gás oxigênio.
Analisando-se as afirmações acima, estão corretas somente
Ca(OH)2 + H3PO4 → Ca3(PO4)2 + H2O
Dados: Massas molares, em g∙mol-1, H2O = 18, Ca(OH)2 = 74, H3PO4 = 98 e Ca3(PO4)2 = 310
é INCORRETO afirmar que
O trióxido de enxofre (SO3) é obtido a partir da reação do dióxido de enxofre (SO2) com o gás oxigênio (O2), representada pelo equilíbrio a seguir.
2 SO2(g) + O2(g) 2 SO3(g) ΔHθ = - 198 kJ
A constante de equilíbrio, KC, para esse processo a 1000o C é igual a 280. A respeito dessa reação, foram feitas as seguintes afirmações:
I. A constante de equilíbrio da síntese do SO3 a 200o C deve ser menor que 280.
II. Se na condição de equilíbrio a 1000o C a concentração de O2 é de 0,1 mol.L-1 e a concentração de SO2 é de 0,01 mol.L-1, então a concentração de SO3 é de 2,8 mol.L-1.
III. Se, atingida a condição de equilíbrio, o volume do recipiente for reduzido sem alteração na temperatura, não haverá alteração no valor da constante de equilíbrio, mas haverá aumento no rendimento de formação do SO3.
IV. Essa é uma reação de oxirredução, em que o dióxido de enxofre é o agente redutor.
• Estão corretas apenas as afirmações:
Fonte: Adaptado da Revista Isto é, 19 de Abril de 2017.
Considerando um adulto de 70,0 kg a quantidade máxima de carne que ele pode consumir para não ultrapassar a IDA do ácido sórbico é de:
A pirita (FeS2 ) é encontrada na natureza agregada a pequenas quantidades de níquel, cobalto, ouro e cobre. Os cristais de pirita são semelhantes ao ouro e, por isso, são chamados de ouro dos tolos. Esse minério é utilizado industrialmente para a produção de ácido sulfúrico. Essa produção ocorre em várias etapas, sendo que a primeira é a formação do dióxido de enxofre, segundo a equação a seguir.
4 FeS2(s)+ 11 O2(g) → 2 Fe2 O3(s) + 8 SO2(g)
Na segunda etapa, o dióxido de enxofre reage com oxigênio para formar trióxido de enxofre e, por fim, o trióxido de enxofre reage com água, dando origem ao ácido sulfúrico.
Sabendo que o minério de pirita apresenta
92% de pureza, calcule a massa aproximada de
dióxido de enxofre produzida a partir de 200 g
de pirita.
A Aspirina, o medicamento mais conhecido e consumido no mundo, completou cem anos em 1999. Além de atuar como analgésico, é anti-inflamatório, antipirético e antiplaquetário. Seu princípio ativo é o ácido acetilsalicílico, C9H8O4 sintetizado pela reação do ácido salicílico, C7H6O3, com anidrido acético, C4H6O3 como mostrado pela equação química:
C7H6O3(s) + C4H6O3(l) → C9H8O4(s) + C2H4O2(l)
Calcule a massa de anidrido acético necessária para consumir completamente 2,00 . 102 g ácido salicílico.
Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16.
Pequenas quantidades de óxido nítrico (NO) ocorrem naturalmente em nossos corpos, nos quais age como um neurotransmissor, ajuda a dilatar os vasos sanguíneos e participa em outras mudanças psicológicas. Considere a reação de obtenção do óxido nítrico a partir de amônia e oxigênio, como mostra a equação química não-balanceada:
x NH3(g) + y O2(g) → z NO(g) + w H2O(g)
Após balancear a referida equação com os menores
números inteiros possíveis, a soma dos coeficientes
estequiométricos é:
HB + 4 O2 → HB(O2) 4
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
KMnO4 + H2O → MnO2 + O2 + KOH
A soma dos menores coeficientes estequiométricos inteiros da equação, quando balanceada, é:
A história de contaminações por metais (rejeitos) das águas dos rios em Minas Gerais é antiga. Segundo informações de pesquisa da Unicamp, há 15 anos, o arsênio no solo e na água utilizada por moradores do Quadrilátero Ferrífero estaria relacionado à intensa mineração de ouro, explorada nos últimos 300 anos.
O arsênio está entre os metais mais nocivos à saúde humana. Quantidades elevadas (acima de 10-5 gramas por litro de água potável) podem provocar vários tipos de cânceres, além de abalos ao sistema nervoso, malformação neurológica e abortos.
(Fonte: Isabel Gardenal, Jornal da Unicamp, novembro de 2002.)
Sobre o arsênio e as informações apresentadas são feitas algumas afirmações. Assinale a correta:
O biodiesel substitui total ou parcialmente o óleo diesel de petróleo em motores automotivos. O seu consumo contribui para a redução da poluição atmosférica, já que o biodiesel não contém enxofre em sua composição, além de gerar alternativas de empregos em áreas geográficas menos propícias para outras atividades econômicas. Tal combustível é obtido a partir da reação química entre óleos vegetais, como demonstrada na fórmula abaixo, ou gorduras, com um álcool, na presença de um catalisador, produzindo um novo éster (biodiesel) e a glicerina (C3H8O3). Admitindo uma reação entre 319 gramas de óleo de soja (massa molar 638g/mol) e metanol em quantidade suficiente, a massa formada de glicerina (massa molar 92 g/mol), numa reação com 50% de rendimento, é de
C39H74O6 + 3 CH3OH ↔ C3H8O3 + 3 C13H26O2