Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, a massa de azida necessária para a formação de 67,2 L
de N2 nas CNTP seria 130 g.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Na reação global, 10 mol de azida geram 16 mol de nitrogênio gasoso.
Após o problema da bateria ter sido resolvido, eles continuaram a viagem. Percorridos alguns
quilômetros Carlos precisou frear bruscamente o veículo, devido a um acidente ocorrido na
rodovia. Passado o susto, Eduardo pergunta com ironia:
- Seu carro tem airbag?
- É obvio que não, responde Carlos.
- Você saberia me dizer como funciona um airbag?
- Não tenho ideia. O que você acha de consultarmos aquele livro de Química?
- Legal!
Então, Eduardo estica a mão e pega, no banco de trás, um livro no qual se lê:
O airbag é formado por um dispositivo que contém a mistura química de NaN3 (azida de sódio), KNO3 e SiO2 que é responsável pela liberação do gás. Esse dispositivo está acoplado a um balão que fica no painel do automóvel e quando ocorre uma colisão (ou desaceleração), os sensores localizados no para-choque do automóvel transmitem um impulso elétrico (faísca) que causa a detonação da reação. Em aproximadamente 25 milésimos de segundo, o airbag está completamente inflado.
Veja as equações do processo:
I - 2 NaN3 → 2 Na + 3N2
II - 10 Na + 2 KNO3 → K2O + 5 Na2O + N2
III - K2O + Na2O + SiO2 → silicato alcalino
Dado: um airbag contém aproximadamente 130 g de azida.
Disponível em: <http://www.brasilescola.com/quimica/air-bag-reacao-decomposicao.htm> (adaptado) Acesso em: 12 set. 2011.
Assinale a proposição CORRETA.
Considerando apenas a equação I, seriam necessários 650 mg de azida de sódio para gerar
336 mL de N2 nas CNTP.
Os astronautas da nave Apollo 13, durante o voo espacial, enfrentaram um sério imprevisto na viagem de retorno à Terra. Os filtros de hidróxido de lítio que eram utilizados para retirar o excesso de gás carbônico do ar da nave ficaram saturados após alguns dias. Este incidente levou a NASA a resolver este problema para futuras viagens espaciais, desenvolvendo uma técnica na qual utilizava a água da urina dos astronautas na reação com o óxido de lítio para formar o hidróxido de lítio. Este, por sua vez, era utilizado na absorção do gás carbônico do ar da nave levando à formação de carbonato de lítio e água. A quantidade de óxido de lítio, para futuras viagens, foi estimada com base na produção diária de 1,8 Kg de água de urina por astronauta.
De acordo com as informações do texto acima, assinale a proposição CORRETA.
Pelos cálculos da NASA, cada astronauta eliminaria, por dia, aproximadamente 3,6 Kg de gás
carbônico na nave espacial.
Os astronautas da nave Apollo 13, durante o voo espacial, enfrentaram um sério imprevisto na viagem de retorno à Terra. Os filtros de hidróxido de lítio que eram utilizados para retirar o excesso de gás carbônico do ar da nave ficaram saturados após alguns dias. Este incidente levou a NASA a resolver este problema para futuras viagens espaciais, desenvolvendo uma técnica na qual utilizava a água da urina dos astronautas na reação com o óxido de lítio para formar o hidróxido de lítio. Este, por sua vez, era utilizado na absorção do gás carbônico do ar da nave levando à formação de carbonato de lítio e água. A quantidade de óxido de lítio, para futuras viagens, foi estimada com base na produção diária de 1,8 Kg de água de urina por astronauta.
De acordo com as informações do texto acima, assinale a proposição CORRETA.
Cada astronauta deve produzir aproximadamente 4,8 Kg de hidróxido de lítio por dia.
Em uma indústria do Estado de São Paulo que produz ácido sulfúrico 98% a partir da queima de enxofre elementar, com capacidade de produção inicial de 600 toneladas por dia, ocorreu uma emissão de gás dióxido de enxofre (SO2). Essa emissão de gás ultrapassou as fronteiras da fábrica de ácido sulfúrico e atingiu a população do entorno. Várias pessoas apresentaram agravos à saúde relacionados ao caso, como irritação das vias aéreas, desmaios, vômitos e enjoos, demandando atendimento hospitalar de emergência em hospitais da região. Também foram acionados o Serviço de Atendimento Médico de Urgência (SAMU) e o Corpo de Bombeiros.
JÚNIOR, L.M.; LORENZI, R.L. Revista brasileira de saúde ocupacional. São Paulo: 32(116): 31-37, 2007. (Adaptado)
Sobre o assunto, é CORRETO afirmar que:
para a produção de 600 toneladas de ácido sulfúrico são necessárias cerca de 400 toneladas
de S.
Dados: MM(Na2 CO3 ) = 106g/mol
Na2 CO3 + HCl⬄ NaCl + H2 CO3

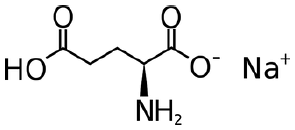
Se 0,1 g de glutamato monossódico for adicionado em um produto alimentício, a massa em miligramas de sódio proveniente desse sal será, aproximadamente:
Três frascos contêm volumes de três líquidos distintos. As suas massas são m₁ = 300 g, m₂ = 200 g e m₃ = 100 g. Os volumes de líquido contidos em cada frasco são V₁ = 280 mL, V₂= 240 mL e V₃ = 80 mL.
Ordene as densidades dos fluidos em ordem decrescente.
O ânion perxenato (XeO64-) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
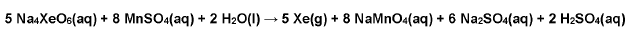
Além disso, o XeO64- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o
xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados
por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é
igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
HB + 4 O2 → HB(O2) 4
Em um experimento, constatou-se que 1 g de hemoglobina é capaz de transportar 2,24 x 10–4 L de oxigênio molecular com comportamento ideal, nas CNTP.
A massa molar, em g/mol, da hemoglobina utilizada no experimento é igual a:
MnO2(s) + H2C2O4(aq) + H2SO4(aq) MnSO4(s) + 2CO2(g) + 2H2O(l)
A implantação de uma empresa de mineração para explorar os recursos naturais de uma região deve considerar os impactos ambientais e a viabilidade econômica do minério que será extraído da crosta terrestre. Para a obtenção do manganês, por exemplo, encontrado em jazidas de pirolusita, que contém o óxido de manganês (IV) e impurezas, é essencial a determinação do teor de MnO2(s), nesse minério, processo realizado em várias etapas em um laboratório. Uma das análises químicas realizadas durante o processo consiste na adição dos ácidos oxálico e sulfúrico, em uma amostra da pirolusita, que reagem de acordo com a equação química.
Considerando-se as informações e as relações estequiométricas entre as substâncias representadas na equação química, é correto concluir:
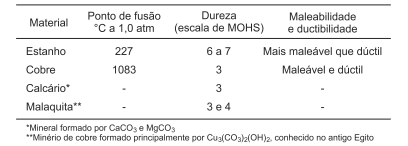
Com base nos conhecimentos de Química e nas propriedades físicas de alguns materiais utilizados na construção da Pirâmide de Quéops, no Egito, por volta de 2525 a.C., é correto concluir:
Não produzir qualquer tipo de resíduo ou poluente é o principal atributo em favor do hidrogênio como combustível para gerar energia elétrica. Ele faz funcionar células de combustível, equipamentos que produzem eletricidade sem danos ambientais. Como uma das fontes de hidrogênio é a água, uma das alternativas, em consonância com a preocupação ambiental, é o reuso da água como produção de energia renovável, utilizando esgotos e efluentes industriais.
O grupo de professores da Escola de Engenharia de São Carlos/USP desenvolveu um método para produzir hidrogênio em um reator de fluxo contínuo, constantemente alimentado com rejeitos que seriam, muitas vezes, descartados sem tratamento em rios e lagoas. No sistema, bactérias anaeróbicas do gênero Clostridium, que não precisam de oxigênio para viver, aderem a partículas de polietileno dentro de um reator.
Nos automóveis, movidos a células de combustível, o consumo de hidrogênio varia de 1,0 a 10,0g/km rodado, segundo um professor do grupo.
(OLIVEIRA, 2009, p. 100).

Com base nas informações do texto e a partir da análise da
figura, que representa a variação da velocidade escalar, em
função do tempo, de um automóvel movido a célula de
combustível, é correto afirmar que o consumo máximo de
hidrogênio, em g, é de
A equação química a seguir representa a obtenção de glicose a partir do glicogênio.
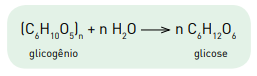
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona
o ganho de energia, em quilojoules, equivalente a:
(C6H10O) n + nH2O → n C6H12O6 glicogênio glicose
Considere uma molécula de glicogênio de massa molar igual a 4,86 x 106 g.mol−1 .
A metabolização da glicose originada da hidrólise dessa molécula de glicogênio proporciona o ganho de energia, em quilojoules, equivalente a:
Dissolução
Au (s) +3 HNO3 (aq) + 4 HCl (aq) → HAuCl4 (aq) + 3 H2 O (l) + 3 NO2 (g)
Recuperação
3 NaHSO3 (aq) + 2 HAuCl4 (aq) + 3 H2 O (l) → 3 NaHSO4 (aq) + 8 HCl (aq) + 2 Au (s)
Admita que foram consumidos 252 g de HNO3 para a completa dissolução das medalhas. Nesse caso, a massa, de NaHSO3 , em gramas, necessária para a recuperação de todo o ouro corresponde a: