Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões
CARGUEIRO COM 2400 TONELADAS DE ÁCIDO
SULFÚRICO VIROU NO RIO RENO
Um cargueiro com 2400 toneladas de ácido sulfúrico virou-se [...] no rio Reno, ao passar pela Alemanha. Dois membros da tripulação estão dados como desaparecidos. [...]
Disponível em: http://www.publico.pt/ciencia/noticia/cargueiro-com-2400-- toneladas-de-acido-sulfurico-virouse-no-rio-reno-1475034. Acesso em: 15 de agosto de 2015.
[Dados: M(H2SO4) = 98 g/mol; M[Ca(OH)2] = 74 g/mol; N.A. = 6,0 ˑ 1023]
Supondo que toda a massa fornecida seja só de ácido sulfúrico, pode-se inferir que
Assinalando (V) verdadeiro ou (F) falso nas afirmações a seguir:
I) A massa de uma molécula de água é 18g.
II) O átomo de alumínio pesa 27 vezes mais que a massa do 12C.
III) Em 1 mol de O2 existem 6,0 x 1023 átomos.
IV) Em 44g de CO2 existem 6,0 x 1023 moléculas.
V) A massa atômica do alumínio é 27u.
Concluímos que são falsas:

Bicarbonato de sódio é uma substância de múltiplas
utilidades, entre elas: é um antiácido; é usado por dentistas para limpeza dos dentes e por cozinheiros para acelerar a cocção de vários alimentos.
Sua fórmula é NaHCO3
Um estudante, que gosta de fazer graça com os outros,foi a uma farmácia e pediu 1 mol de bicarbonato de sódio.
O farmacêutico, que sabia bastante química (obviamente), informou ao estudante que tinha uma embalagem de 80 gramas e que esta quantidade teria,aproximadamente, 1 mol de bicarbonato de sódio.
Na verdade, podemos afirmar que
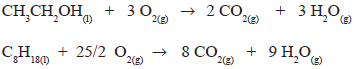
Considerando um tanque de combustível de 55 L, em que o automóvel A foi abastecido com álcool e o automóvel B com gasolina, qual o volume aproximado em L de gás carbônico, nas condições normais de temperatura e pressão, que será emitido pelos automóveis, respectivamente?
Considerar: - Volume molar dos gases nas CNTP, Vm= 22,7 L - densidade do etanol = 0,8 g.mL-1 - densidade do iso-octano = 0,7 g.mL-1
Na reação de oxidação de um composto orgânico X, foi consumido 128 g de oxigênio, com produção de 132 g de gás carbônico e 54,06 g de água, conforme reação abaixo. O composto orgânico X e os coeficientes estequiométricos para os produtos seriam, respectivamente,
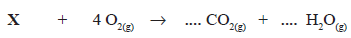
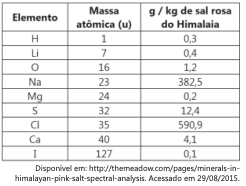
Mesmo que o sal rosa do Himalaia ofereça mais benefícios à saúde, a substituição do sal refinado por ele não contribui significativamente para a diminuição da ingestão do elemento causador da hipertensão, porque, para cada quilograma de sal refinado substituído por sal rosa do himalaia, a massa de sódio seria, aproximadamente:
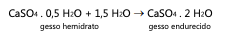
O conhecimento do processo químico de endurecimento do gesso permite avaliar possíveis alterações em sua massa. De fato, a equação química apresentada permite constatar que, após seu preparo, aplicação e endurecimento, o gesso apresenta:
Dados: massas moleculares (g/mol): H = 1, O = 16, S = 32, Ca = 40.
SiO2(s) + 6 HF(aq) → SiF62−(aq) + 2 H3O+ (aq)
Calcule a massa de ácido fluorídrico necessária para reagir com 1,0 kg de SiO2.
Dados: Massas molares em g . mol-1 : H = 1; F = 19; O = 16; Si = 28.
Em nota, a Cetesb informa que tal situação só aconteceu no período em que houve corrente dos gases na atmosfera. http://www.atribuna.com.br/cidades/cubat%C3%A3o/vazamento-de-g%C3%A1sprovocou-chuva-%C3%A1cida-em-cubat%C3%A3o-diz-cetesb-1.426246
Supondo-se que o volume de dióxido de enxofre, descarregado na atmosfera, tenha sido de 1120 L, nas CNTP, a massa de ácido sulfuroso que foi produzida, por meio da reação representada pela equação SO2 + H2O → H2SO3, considerando o rendimento do processo igual a 60%, é
Dado: massa molar (g.mol-1) H = 1, O = 16 e S = 32.
Jornal o Estado do Maranhão. Adaptado.
Suponha que determinada gasolina seja composta de hidrocarbonetos com fórmula (C8H18). Nessas condições, as equações químicas que representam as reações de combustão completas do etanol e do octano, devidamente balanceadas, permitem afirmar que a combustão de
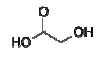 e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
e é produzido pela reação do ácido cloroacético com o
hidróxido de sódio seguida por uma re-acidificação. A
reação pode ser equacionada da seguinte maneira:
ClCH2CO2H + NaOH → HOCH2CO2H + NaCl
Desta forma, alguns milhões de quilogramas de ácido glicólico são produzidos anualmente.
Calcule a quantidade de ácido glicólico produzida a partir de 200 g de ácido cloroacético e 70,0 g de hidróxido de sódio. Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; Na = 23; Cl = 35,5.
x Au(s) + y NO3− (aq) + w H+ (aq) + z Cl− (aq) → a AuCl4− (aq) + b H2O(l) + d NO(g)
Após balancear a equação acima com os menores números possíveis, correspondentes, a soma dos coeficientes estequiométricos será:

ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0

Em 2013, uma das descobertas de maior importância do
ponto de vista tecnológico foi a criação de unidades fotovoltaicas
à base de perovskita, termo que designa um tipo de óxido com
fórmula geral ABO3, em que A e B representam cátions metálicos.
Um exemplo típico é o CaTiO3. A unidade básica do cristal de uma
perovskita consiste na estrutura cúbica mostrada na figura acima,
em que cada um de oito cátions “A” ocupa um dos vértices do cubo;
seis íons oxigênio estão nos centros das faces do cubo, formando
um octaedro regular; e um cátion “B” está no centro do cubo.
Considerando essas informações e que o número de Avogadro seja igual a 6,0 × 1023, julgue o item.
O número de átomos de cálcio presentes em 27,2 g de CaTiO3
é 1,2 × 1023.

O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
O consumo excessivo de sal pode acarretar o aumento da pressão das artérias, também chamada de hipertensão. Para evitar esse problema, o Ministério da Saúde recomenda o consumo diário máximo de 5 g de sal (1,7 g de sódio). Uma pessoa que consome a quantidade de sal máxima recomendada está ingerindo um número de íons sódio igual a
Dados:
Massa molar do Na = 23,0 g/mol.
Constante de Avogadro: 6,0 × 1023 mol−1.
O bronze campanil, ou bronze de que os sinos são feitos, é uma liga composta de 78% de cobre e 22% de estanho, em massa. Assim, a proporção em mol entre esses metais, nessa liga, é, respectivamente, de 1,0 para
Dados:
Massas molares (g/mol)
Cu = 63,5
Sn = 118,7

