Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 627 questões



Um dos álcoois mais comuns, o etanol, queima completamente segundo a reação
C2H6O (l) + 3O2 (g) → 2CO2 (g) + 3H2O (g)
Considerando que todos os produtos dessa reação são gasosos, o volume de gás total, em m3 , produzido quando é queimado 1,0 kg de etanol, nas CNTP, é de, aproximadamente,
Dados:
Massas molares (g.mol−1 )
H = 1,0
C = 12,0
O = 16,0
Volume molar, nas CNTP = 22,4 L.mol−1
O mineral calcita, CaCO3, é um dos principais constituintes do mármore. Esse mineral pode ser dissolvido com ácidos, porque ocorre a seguinte reação:
CaCO3 (s) + 2H+ (aq) → Ca2+ (aq) + CO2 (g) + H2O (l)
Considerando uma solução de ácido clorídrico cujo pH = 0, o volume dessa solução, em mL, necessário para dissolver 1,0 g de CaCO3 é deMassa molar do CaCO3 = 100 g.mol−1
TEXTO 8
CAPÍTULO XVIII
Rubião e o cachorro, entrando em casa, sentiram, ouviram a pessoa e as vozes do finado amigo. Enquanto o cachorro farejava por toda a parte, Rubião foi sentar-se na cadeira, onde estivera quando Quincas Borba referiu a morte da avó com explicações científicas. A memória dele recompôs, ainda que de embrulho e esgarçadamente, os argumentos do filósofo. Pela primeira vez, atentou bem na alegoria das tribos famintas e compreendeu a conclusão: “Ao vencedor, as batatas!”. Ouviu distintamente a voz roufenha do finado expor a situação das tribos, a luta e a razão da luta, o extermínio de uma e a vitória da outra, e murmurou baixinho:
— Ao vencedor, as batatas!
Tão simples! tão claro! Olhou para as calças de brim surrado e o rodaque cerzido, e notou que até há pouco fora, por assim dizer, um exterminado, uma bolha; mas que ora não, era um vencedor. Não havia dúvida; as batatas fizeram-se para a tribo que elimina a outra a fim de transpor a montanha e ir às batatas do outro lado. Justamente o seu caso. Ia descer de Barbacena para arrancar e comer as batatas da capital. Cumpria-lhe ser duro e implacável, era poderoso e forte. E levantando-se de golpe, alvoroçado, ergueu os braços exclamando:
— Ao vencedor, as batatas!
Gostava da fórmula, achava-a engenhosa, compendiosa e eloquente, além de verdadeira e profunda. Ideou as batatas em suas várias formas, classificou-as pelo sabor, pelo aspecto, pelo poder nutritivo, fartou- -se antemão do banquete da vida. Era tempo de acabar com as raízes pobres e secas, que apenas enganavam o estômago, triste comida de longos anos; agora o farto, o sólido, o perpétuo, comer até morrer, e morrer em colchas de seda, que é melhor que trapos. E voltava à afirmação de ser duro e implacável, e à fórmula da alegoria. Chegou a compor de cabeça um sinete para seu uso, com este lema: AO VENCEDOR AS BATATAS.
Esqueceu o projeto do sinete; mas a fórmula viveu no espírito de Rubião, por alguns dias: — Ao vencedor as batatas! Não a compreenderia antes do testamento; ao contrário, vimos que a achou obscura e sem explicação. Tão certo é que a paisagem depende do ponto de vista, e que o melhor modo de apreciar o chicote é ter-lhe o cabo na mão.
(ASSIS, Machado de. Quincas Borba. São Paulo: Ática,
2011. p. 38-39.)
O brim é um tecido composto principalmente de algodão. É comumente tingido de índigo (colorante azul) que tem uma produção anual de 50 mil toneladas. A maioria dessa produção (95%) é destinada à indústria têxtil. Devido à baixa afinidade do índigo pela fibra de algodão, somente a superfície dos fios fica azul, deixando o núcleo da fibra com coloração branca. Estima-se que cerca de 15% do índigo usado na indústria têxtil é descartado como resíduo. Esse resíduo, quando não tratado corretamente, acaba causando sérios problemas ambientais.
O algodão tem em sua constituição 94% de celulose, cuja fórmula molecular é (C6 H10O5 )n. A celulose é um polissacarídeo formado por um único monômero (a glicose: C6 H12O6 ). Ela pode apresentar uma configuração aberta ou fechada, dependendo do ambiente químico.
Assinale a única alternativa correta com relação ao exposto acima:
Obrigatório desde 1997, o componente reduz as emissões
provenientes da queima de combustível
Na época de frio, a qualidade do ar tende a piorar e, para não tornar a situação ainda mais crítica, é preciso atenção ao catalisador do veículo. A peça pode transformar mais de 90% dos gases tóxicos em derivados menos poluentes. [...]
O principal indício de problemas no catalisador é a perda de potência. “Combustível adulterado provoca a ineficiência da reação química que faz a catálise, o que afeta o rendimento", explica o diretor Associação de Engenharia Automotiva (AEA), Alfredo Castelli.
A cor da fumaça que sai pelo escapamento não está relacionada a defeitos na peça. Nesse caso, indica que há algo de errado com o motor.
Thais Villaça
O Estado de São Paulo, 28.05.14
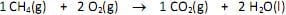
Nessas condições, na queima de 32 mg de metano, será lançada, pelo escapamento do veículo, uma massa de gás carbônico igual a
Dados: H = 1, C = 12, O = 16
RS não deve chegar à costa Catarinense
Mancha se alastrou a uma área equivalente
a 100 campos de futebol
O Litoral catarinense não deve ser afetado com o derramamento de óleo que aconteceu na última
quinta-feira, em Tramandaí (RS), de acordo com o Instituto Nacional do Meio Ambiente (Ibama). Foram cerca de 1,2 mil litros de óleo que caíram no mar, próximo a Tramandaí, no Litoral Norte do Rio Grande do Sul. [...]
A mancha de óleo se alastrou pelo mar e chegou a ocupar uma área equivalente a 100 campos
de futebol. [...] O volume estimado de óleo derramado é de 1,2 m³.
Diário Catarinense, 27.01.2012. Texto adaptado.
Disponível em: http://diariocatarinense.clicrbs.com.br/sc/geral/n...
ento-de-oleo-no-litoral-norte-do-rs-nao-deve-chegar-a-costa-catarinense- 3645427.html
Acesso em 04.07.2014


II) O ácido nítrico em água tem como base conjugada o íon nitrato, NO .
III) Para cada litro de solução de ácido nítrico obtido tem-se 980 g deste ácido dissolvidos.
IV) A concentração da solução aquosa de ácido nítrico obtido é de 15,6 mol/l.
V) Por meio de uma destilação é possível elevar o teor de ácido nítrico na solução obtida.
A sequência correta que corresponde, respectivamente, à questão é
Al2(SO4)3 + 3Ca(OH)2 → 2 Al(OH)3 + 3CaSO4
Para tratar 1,0x106m3 de água foram adicionadas 17 toneladas de Al2(SO4)3. Qual a massa de Ca(OH)2 necessária para reagir completamente com esse sal? Dados: massas molares Al2(SO4)3 = 342 g/mol Ca(OH)2 = 74 g/mol
Fe(s) + HCℓ(aq) → FeCℓ2(aq) + H2(g)
Assim, pode-se afirmar que as massas de ferro na amostra e de hidrogênio liberada por essa reação são, respectivamente,
Dados: massas molares (g.mol-1): H = 1, Cℓ = 35,5 e Fe = 56
H2O2 → H2O + 1/2 O2
Utilizando-se a equação dos gases ideais P · V = n · R · T (R = 0,082 atm · L · K–1 · mol–1 ), a pressão, em atm, exercida por uma amostra de gás oxigênio confinado em um cilindro de 30 L a 300 K, resultante da decomposição completa de 10 mol de H2O2, é
H2SO4 + Ca(NO3)2 → CaSO4 + 2 HNO3
A massa de sulfato de cálcio produzida, em gramas, quando 5 mol de nitrato de cálcio reagem com ácido sulfúrico em excesso, é
massa 93,45 g volume inicial. 34,5 mL volume final. 45,0 mL
Os alunos determinaram corretamente que a densidade da liga metálica, em g/mL, era de

Considere um reservatório hipotético com água de densidade 1 g/mL e volume igual ao do “volume morto” do Sistema Cantareira. Se a água desse reservatório encontra-se contaminada com 20 ppm de chumbo, a massa total deste metal na água do reservatório hipotético é
Uma amostra de 4,99 g desse sal hidratado foi aquecida até que toda a água nela contida evaporou, obtendo-se uma massa de 3,19 g de sulfato de cobre II. O número de mols de água por mol de sulfato de cobre II na composição do sal hidratado equivale a:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0