Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
O dihidrogenofosfato de sódio, NaH2PO4, é um conservante utilizado em alimentos.
Em relação a esse conservante, é correto afirmar:
Em motores de foguetes, ocorre a seguinte reação de hidrazina com peróxido de hidrogênio:
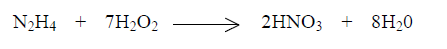
Para a produção de 630,1 gramas de ácido nítrico, são necessários quantos mols de hidrazina (N2H4)?
O biodiesel substitui total ou parcialmente o óleo diesel de petróleo em motores automotivos. O seu consumo contribui para a redução da poluição atmosférica, já que o biodiesel não contém enxofre em sua composição, além de gerar alternativas de empregos em áreas geográficas menos propícias para outras atividades econômicas. Tal combustível é obtido a partir da reação química entre óleos vegetais, como demonstrada na fórmula abaixo, ou gorduras, com um álcool, na presença de um catalisador, produzindo um novo éster (biodiesel) e a glicerina (C3H8O3). Admitindo uma reação entre 319 gramas de óleo de soja (massa molar 638g/mol) e metanol em quantidade suficiente, a massa formada de glicerina (massa molar 92 g/mol), numa reação com 50% de rendimento, é de
C39H74O6 + 3 CH3OH ↔ C3H8O3 + 3 C13H26O2
Sem dúvidas, o maior crescimento do feto ocorre durante o último trimestre de gestação; seu peso quase duplica durante os últimos 2 meses de gestação. Comumente, a mãe não absorve proteínas, cálcio, fosfatos e ferro suficientes pela dieta, durante os últimos meses de gestação para suprir essas necessidades extras do feto. Entretanto, antecipando essas necessidades extras, o corpo da mãe já armazenou essas substâncias – parte na placenta, mas a maioria nos depósitos normais da mulher. Se os elementos nutricionais apropriados não estiverem presentes na dieta da gestante, pode ocorrer uma série de deficiências maternas, especialmente de cálcio, fosfatos, ferro e vitaminas. Por exemplo, o feto precisa de cerca de 375 miligramas de fero para formar seu sangue, e a mãe precisa de outros 600 miligramas para formar seu próprio sangue extra. A reserva normal de ferro não ligado à hemoglobina na mulher, no início da gravidez, geralmente fica em torno de 100 miligramas e quase nunca acima de 700 miligramas. Por isso, sem ferro suficiente na dieta, a gestante muitas vezes desenvolve anemia hipocrômica.
JOHN E. HALL. Tratado de fisiologia médica. 12º ed Rio de Janeiro: Elsevier, 2011.
Na profilaxia e tratamento da anemia hipocrômica, normalmente são utilizados medicamentos à base de Ferro. Num dos mais comuns, o ferro apresenta-se na forma de “ferro aminoácido quelato”, fórmula química C4H8N2O4Fe. Quantos milimols de ferro ao dia um paciente que utilize diariamente a posologia de 265mg do medicamento ingere? (Dados: C = 12,0 g/mol; H = 1,0 g/mol; N = 14,0 g/mol; O = 16,0 g/mol; Fe = 53,0 g/mol)
Da forma semelhante a outros óxidos, o SO2 reage com a água formando o ácido sulfuroso: SO2 (g) + H2O (l) → H2SO3 (aq) H2SO3 (aq) → H+ (aq) + HSO3- (aq)
O SO2 pode ainda sofrer oxidação na atmosfera e formar o trióxido de enxofre (SO3), o qual, por sua vez, em contato com a água da chuva, formará o ácido sulfúrico (H2SO4), que é um ácido forte. SO2 (g) + ½ O2 (g) → SO3 (g) SO3 (g) + H2O (l) → H2SO4 (aq) H2SO4 (aq) → 2H+ (aq) + SO4 2- (aq)
Assumindo que a fórmula química do carvão é C135H96O9NS e que uma usina termelétrica movida a carvão queima cerca de 2,74 x 106 kg de carvão por dia, a quantidade em mols de SO2 despejados na atmosfera durante a queima deste carvão, em um dia normal, é (Dados: S = 32,0 g/mol; C = 12,0 g/mol; H = 1,0 g/mol; O = 16 g/mol; N = 14 g/mol)
As minas de columbita e tantalita, minérios que produzem o composto coltan, exterminaram a maioria da população de gorilas e elefantes da República Democrática do Congo. Sua produção envolve, além da matança de animais, profunda exploração humana e ambiental. O coltan é um mineral importante para a fabricação de celulares, TVs de plasma, notebooks, câmeras digitais, satélites artificiais e diversas outras tecnologias. E suas matérias-primas, columbita e tantalita, têm seu maior foco de extração na África, que corresponde a 80% de todo o coltan utilizado pelas indústrias eletroeletrônicas do mundo. Os métodos de extração são rudimentares e promovem profunda exploração humana. São camponeses, prisioneiros de guerra, refugiados de guerra e crianças que extraem columbita e tantalita, sempre vigiados por militares. Os resultados são a vedação do direito das crianças à escola, mortes por desabamentos de túneis, doenças por falta de água limpa, saneamento e alimento, a disputa de grupos armados por cada mina, mortes de crianças (estima-se que cada quilo de coltan implicou a morte de duas crianças), transformação de bosques e campos agrícolas em lodaçais, desalojamentos forçados, violação de mulheres e meninas etc. As consequências ambientais também são alarmantes: para a extração de coltan, invadiram parques ecológicos nacionais da República Democrática do Congo, e matou-se 80% da população de elefantes e 90% da de gorilas do país, levando sua população quase à extinção local. Afirma-se que a maioria das multinacionais fabricantes de celulares está envolvida na compra do coltan congolês e na manutenção de governos corruptos e de guerras pela extração das matérias-primas desse mineral. O coltan é um exemplo gritante de como o capitalismo passa por cima da dignidade humana e da vida animal para o almejamento do lucro e do atendimento de “necessidades” não tão necessárias e de como a indústria corporativa de hoje não tem qualquer senso de responsabilidade socioambiental, nem mesmo de respeito à vida. Na impossibilidade de um boicote total às empresas compradoras do coltan congolês, vale as pessoas tentarem comprar o mínimo possível de eletroeletrônicos portáteis, pelo bem dos animais humanos e não humanos que vêm sendo explorados e massacrados na República Democrática do Congo.
SOUZA, ROBSON FERNANDO. Minas de coltan mataram maioria dos elefantes e gorilas do Congo. Disponível em:. Acesso:<http://www.anda.jor.br/21/06/2012/minas-de-coltan-mataram-maioria-dos-elefantes-e-gorilas-do-congo> 01 maio 2017.
A columbita, um mineral rico em nióbio, possui a fórmula molecular FeNb2O6 e faz parte da pauta de exportação mineral do Brasil, tendo sido exportadas, no ano de 2012 cerca de 71 mil toneladas do minério. A quantidade de nióbio exportada pelo Brasil em 2012 foi de, aproximadamente, (Dados: Fe= 56 g/mol, Nb=93 g/mol e O=16,0 g/mol).




Massa molar do NaHCO3 = 84 g/mol Constante de Avogadro: 6 × 1023 mol–1
Pode-se concluir corretamente que, na combustão completa de 1 mol desse hidrocarboneto, as quantidades de matéria, e CO2 e de H2O produzidas são, em mol, respectivamente, iguais a
AlP (s) + 3 H2O (l) → Al (OH)3 (s) + PH3 (g)
Considerando que toda a massa de fosfeto de alumínio reagiu com a água e que o rendimento da reação é 100%, o volume aproximado de fosfina produzido no local, em litros, é
Dados: Volume molar dos gases nas condições descritas: 30 L/mol
Massas molares em g/mol: Al = 27, P = 31

4 Li (s) + O2 (g) → 2 Li2O (s)
A massa de lítio necessária para reagir completamente com 3,2 kg de oxigênio é, em quilogramas,
Massas molares: Li: 7 g/mol O: 16 g/mol
Assinale a alternativa que apresenta a fórmula molecular e a quantidade mínima, em kg, de gás oxigênio necessária para a combustão completa de 5,6 kg desse combustível.
Massas Molares: H = 1 g/mol O = 16 g/mol C = 12 g/mo
Dados: Massa Molar: O = 16 g/mol

O nitrato de amônio NH4NO3(s) é utilizado na agricultura como fertilizante para promover o crescimento e a frutificação de plantas, entretanto é um explosivo potente que, ao se decompor, libera, rapidamente, um volume muito grande de gases de acordo com a equação termoquímica.
A partir dessas informações, dessa equação termoquímica e admitindo-se que os gases desprendidos na explosão são ideais, é correto afirmar:
A indústria de alimentos e o Ministério da Saúde firmaram compromisso de reduzir gradualmente o teor de sódio, em 16 tipos de alimentos, até 2020. Segundo o Ministério da Saúde, o brasileiro consome, em média, 9,6g diárias de sal, NaCl, quando a Organização Mundial de Saúde, OMS, recomenda o consumo máximo de 5,0g diárias. O excesso de sal na dieta está associado a maior risco de doenças, como hipertensão, problemas cardiovasculares, renais e câncer.
Uma análise dessas informações e da tabela permite
corretamente afirmar:
2 H2(g) + O2(g) → 2 H2O(g) ∆H= - 483,6 kJ
A reação acima é uma reação:
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
Estabelecida à devida proporção, assinale a alternativa correta.
