Questões de Vestibular
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 623 questões
A fermentação alcoólica é um processo biológico no qual açúcares como a sacarose, conforme reação abaixo, são convertidos em energia celular, com produção de etanol e dióxido de carbono como resíduos metabólicos.
C12H22O11 + H2O → 4 CH3CH2OH + 4 CO2
A quantidade, em g, de açúcar necessária para preparar 1 L de aguardente, contendo 46% em massa de etanol, é aproximadamente
ANO INTERNACIONAL DA TABELA PERIÓDICA
Há 150 anos, a primeira versão da tabela periódica foi elaborada pelo cientista Dimitri Mendeleiev. Trata-se de uma das conquistas de maior influência na ciência moderna, que reflete a essência não apenas da química, mas também da física, da biologia e de outras áreas das ciências puras. Como reconhecimento de sua importância, a UNESCO/ONU proclamou 2019 o Ano Internacional da Tabela Periódica.
Na tabela proposta por Mendeleiev em 1869, constavam os 64 elementos químicos conhecidos até então, além de espaços vazios para outros que ainda poderiam ser descobertos. Para esses possíveis novos elementos, ele empregou o prefixo “eca”, que significa “posição imediatamente posterior”. Por exemplo, o ecassilício seria o elemento químico a ocupar a primeira posição em sequência ao silício no seu grupo da tabela periódica.
Em homenagem ao trabalho desenvolvido pelo grande cientista, o elemento químico artificial de número
atômico 101 foi denominado mendelévio.
Considere uma amostra laboratorial de 0,43 g de mendelévio.
O número de átomos presentes nessa amostra equivale a:
Com o reflorestamento, é possível minimizar os efeitos do aquecimento global, tendo em vista que uma árvore consegue captar, em média, 15,6 kg do CO2 lançado na atmosfera por ano. Sabe-se que, na combustão completa da gasolina, todos os átomos de carbono são convertidos em moléculas de CO2.
Admitindo que 1 litro de gasolina contém 600 g de isoctano (C8H18) e 200 g de etanol (C2H6O), no período de 1 ano, uma árvore será capaz de captar o CO2 emitido na combustão completa de x litros de gasolina.
O valor de x corresponde, aproximadamente, a:
O Cardanol é um fenol obtido do líquido da castanha de caju (LCC), a partir do processo de aquecimento a que as castanhas são submetidas para fins alimentícios, de modo a romper a casca externa e liberar o óleo.
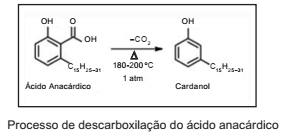
Sendo o LCC um subproduto de agronegócio do caju e
correspondente a, aproximadamente, 25% do peso da castanha, supõe-se que 5% desse líquido seja o ácido anacárdico. Assim, para produzir 5.96 toneladas de Cardanol,
supondo que sua massa molar seja de aproximadamente,
298 g/mol, a quantidade necessária de castanhas em toneladas é de:
Os cosméticos, como batons e rímeis, buscam realçar o encanto da beleza. Porém, o uso desses produtos pode, também, causar desencantamento em função dos constituintes químicos tóxicos que possuem. Em batons, pode haver presença de cádmio, chumbo, arsênio e alumínio. A FDA (Food and Drug Administration) e a ANVISA (Agência Nacional de Vigilância Sanitária) preconizam limites máximos de metais apenas para corantes orgânicos artificiais utilizados como matéria-prima na fabricação de cosméticos.
Considerando que um determinado batom possua concentração de chumbo igual a 1,0 mg Kg−1 e que a estimativa máxima de utilização deste cosmético ao longo do dia seja de 100 mg, assinale a alternativa que representa, correta e aproximadamente, o número de átomos de chumbo em contato com os lábios ao longo de um dia.
Dados:
Massa molar de chumbo = 207 g mol−1
Constante de Avogadro = 6,0 x 1023 mol−1
Vinagre é uma mistura homogênea cujo principal constituinte é o ácido acético. Um estudante de química analisou uma amostra de uma garrafa de 500mL de vinagre de maçã, em que, no rótulo, há a informação de que o teor do ácido acético presente na solução é de 4,2% m/v.
Considerando que o ácido acético é o único composto de caráter ácido do vinagre, analise as proposições sugeridas pelo estudante após as análises.
I- A molaridade do ácido acético na amostra analisada é 0,7mol/L.
II- Ao titular 20mL desse vinagre com hidróxido de sódio 1mol/L, foram gastos 50mL da base.
III- Uma cozinheira que utiliza 6,3g de vinagre por dia, durante 30 dias, irá utilizar 9 garrafas.
Está(ão) CORRETA(S) a(s) afirmativa(s):
Um grupo de alunos do curso de Química, ao entrar no laboratório para uma atividade, deparou-se com alguns recipientes não rotulados, embora todos contivessem uma substância líquida e incolor.
Considerando as substâncias, os acadêmicos determinaram as seguintes propriedades para reconhecimento: 1) massa, 2) volume, 3) ponto de ebulição, 4) densidade.
Com base nestas informações, indique quais propriedades possibilitaram aos acadêmicos a identificação das substâncias:
O fermento químico é um ingrediente muito utilizado na cozinha para fazer crescer as massas, sendo a principal a de farinha de trigo. O crescimento ocorre devido à formação de gás carbônico dentro da massa, quando o fermento é adicionado a ela. Graças a ele, podemos provar alimentos macios e de digestão fácil. Observe a reação entre as substâncias que compõem um determinado fermento químico, quando o mesmo é adicionado à massa de um alimento que está sendo produzido:
8NaHCO3 + 3Ca(H2PO4)2 → Ca3(PO4)2 + 4Na2HPO4 + 8CO2 + 8H2O
Considerando a reação dada, qual é a massa, em gramas, de CO2 produzido quando 60 gramas de NaHCO3 reagem totalmente com Ca(H2PO4)2?
Dados: NaHCO3: 84 g/mol; CO2: 44 g/mol
Leia o texto para responder a questão.

Voando na altitude de cruzeiro com uma velocidade média, em relação ao solo, de 800 km/h, um Boeing 737-800 percorreu uma distância de 2400 km.
Considere que:
• o QAV é constituído por hidrocarbonetos cujas cadeias
carbônicas contêm, em média, 12 átomos de carbono
e 26 átomos de hidrogênio, apresentando massa molar
média de 170 g/mol;
• a combustão do QAV na altitude de cruzeiro é completa.
De acordo com os dados, a massa de CO2
(g) gerada pela
combustão do QAV na distância percorrida pelo avião foi próxima de
Dentre os diversos agentes tóxicos, o arsênio é historicamente famoso por se tratar de uma substância muito utilizada na Idade Média para assassinatos com interesses políticos. Podemos até dizer que a morte por arsênio foi a precursora da química forense. Na época, havia uma epidemia desses casos, cuja prevenção era muito difícil, uma vez que óxido de arsênio, As2O3, é um sólido branco, solúvel, sem cheiro e gosto, sendo dificilmente detectado por análises químicas convencionais, o que lhe deu o status de óxido do crime perfeito. Além disso, o óxido de arsênio (III) é um composto muito utilizado na fabricação de vidros e inseticidas. Ele é convertido em ácido arsenioso (H3AsO3 ) em contato com água. Um método para se determinar o teor de arsênio é por meio de oxidação com permanganato de potássio e ácido sulfúrico, conforme equação não balanceada a seguir:
H3AsO3 + KMnO4 + H2SO4 → H3AsO4 + K2SO4 + MnSO4 + H2O
Sabendo que para 2,000 g de amostra foram gastos
10,00 mL de uma solução de KMnO4 0,05 M, em que ocorre a reação acima completa, em meio de ácido sulfúrico, o
percentual de arsênio na amostra é:
O cinamaldeído é um dos principais compostos que dão o sabor e o aroma da canela. Quando exposto ao ar, oxida conforme a equação balanceada:
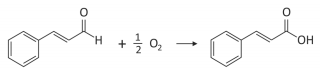
Uma amostra de 19,80 g desse composto puro foi exposta ao ar por 74 dias e depois pesada novamente, sendo que a massa final aumentou em 1,20 g. A porcentagem desse composto que foi oxidada no período foi de
Note e adote:
Massas molares (g/mol):
Cinamaldeído = 132; O2 = 32
Considere que não houve perda de cinamaldeído ou do produto de oxidação por evaporação.
Uma amostra sólida, sem cavidades ou poros, poderia ser constituída por um dosseguintes materiais metálicos: alumínio, bronze, chumbo, ferro ou titânio. Para identificá‐la, utilizou‐se uma balança, um recipiente de volume constante e água. Efetuaram‐se as seguintes operações: 1) pesou‐se a amostra; 2) pesou‐se o recipiente completamente cheio de água; 3) colocou‐se a amostra no recipiente vazio, completando seu volume com água e determinou‐se a massa desse conjunto. Os resultados obtidos foram os seguintes:
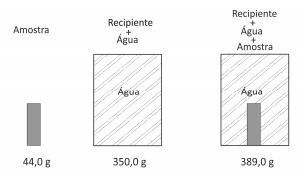
Dadas as densidades da água e dos metais, pode‐se concluir que a amostra desconhecida é constituída de
Note e adote:
Densidades (g/cm3 ):
água = 1,0; alumínio = 2,7; bronze = 8,8;
chumbo = 11,3; ferro = 7,9; titânio = 4,5.
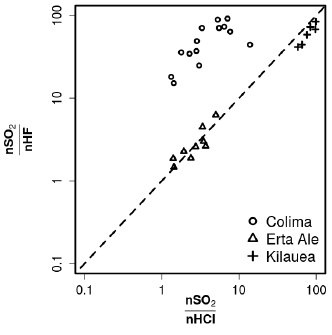
De acordo com a figura, em relação às quantidades de gases dissolvidos no magma, é correto afirmar que as concentrações de SO2 são maiores que as de HF e de HCl
“Só para você ter ideia dos riscos, organizações internacionais de saúde indicam que a ingestão diária de sódio para cada pessoa seja de 2,3 gramas. O glutamato é composto por 21% de sódio e, com certeza, não será o único tempero a ser acrescentado ao seu almoço ou jantar. Além disso, o realçador (glutamato) só conta um terço do nutriente que é encontrado no sal de cozinha.”
Dados de massas molares em g·mol-1: sódio = 23, cloreto = 35,5, glutamato monossódico = 169.
Para tornar a argumentação do artigo mais consistente do ponto de vista químico, você sugeriria a seguinte reescrita dos trechos destacados:
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Leia o texto a seguir e responda à questão.
O rompimento da barragem da Samarco em novembro de 2015 em Mariana (MG) é um dos maiores desastres do século XXI, considerando o volume de rejeitos despejados no meio ambiente.
Pesquisadores apontam que o resíduo sólido da barragem é constituído por Goethita 60%, Hematita (óxido de ferro) 23%, Quartzo (SiO2) 11,0%, Caulinita Al2Si2O5(OH)4 5,9% e alguns metais, tais como bário, chumbo, crômio, manganês, sódio, cádmio, mercúrio e arsênio.
(Adaptado. Disponível em: <http://agenciabrasil.ebc.com.br/ geral/noticia/2016-01/desastre-em-mariana-e-o-maior-acidentemundial-com-barragens-em-100-anos>. Acesso em: 26 abr 2017.)
Dados: Massas atômicas de: Fe = 56 u; O = 16 u;
Si = 28 u; Al = 27 u; H = 1 u.
Um certo metal (M), de massa molar igual a 48 g mol-1 , forma um sal de cloreto bastante reativo, que em água sofre hidrólise e produz o óxido desse metal. Verificou-se que na composição de 80 g do óxido, 48 g correspondem a massa apenas do metal.
(Dado: massa molar do oxigênio igual a 16 g mol-1 )
A fórmula mínima desse óxido é:
HABER-BOSCH: O PROCESSO RESPONSÁVEL POR ALIMENTAR
MUITA GENTE NESTE PLANETA
Estima-se que aproximadamente 45% da população mundial só estão aqui em função do desenvolvimento do processo Haber-Bosch e da produção de amônia. Sem os fertilizantes nitrogenados, nós não teríamos condições de produzir a quantidade de alimentos necessária para alimentar a população que temos hoje no mundo, que está em torno de 7,3 bilhões de pessoas, com tendência a chegar a 9 ou 10 bilhões por volta de 2050. O processo Haber-Bosh descreve uma técnica para obtenção da amônia a partir do nitrogênio do ar atmosférico e do hidrogênio e de fatores como altas temperaturas e pressão.
Disponível em:<https://www.acontecenoticias.com.br/single-post/2017/09/27/Haber-Bosch-O-Processo-Respons%C3%A1velpor-Alimentar-Muita-Gente-Neste-Planeta> . Acesso em: 01/04/18.
A equação não balanceada que descreve a reação de produção de amônia é mostrada a seguir:
N2(g) +H2(g) ⇌ NH3(g)
Ao reagir 50 mols de N2 e 30 mols de H2, qual a quantidade de NH3 produzida em gramas se a reação de síntese for completa?
Dados: N=14 g/mol; H=1g/mol


