Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
NaCl + MnO2 + H2SO4 → Na2SO4 + Cl2 + H2O
Sabendo que a mesma teve um rendimento de 80% e foi realizada a uma temperatura de 27 °C e a uma pressão de 1 atm e que utilizou 600 g de NaCl, o volume de Cl2 obtido, em litros, foi, aproximadamente,
Considere que um atleta com M kg de massa, partindo do repouso, comece a correr com aceleração constante de a m/s² ; que, enquanto corre, o atleta sofre a ação de uma força de resistência constante igual a R newtons; que toda a energia do atleta resulta da oxidação de gordura, a qual é representada pela expressão a seguir, em que E é a energia, em joules, liberada por mol de gordura.
C3H5O3(OC4H7)3 + 18,502 ? 15CO2 + 13H2O + E
Supondo-se que a eficiência do atleta seja 0, então a expressão matemática que representa a quantidade de moles N de gás carbônico produzido pelo atleta até o tempo t, em segundos, transcorrido desde o momento em que ele iniciou a corrida, é
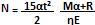
Considere que uma pessoa que pese 60 kg tenha subido, com velocidade constante, uma ladeira de 30° de inclinação, mantendo uma respiração que consome 0,78 L de O2 por minuto. Nesse caso, se toda a produção de energia interna vier da oxidação de glicose, então essa pessoa terá caminhado, em uma hora, menos de 3,5 km.
A massa molar da fórmula molecular mínima do ibuprofeno é 220,0 g/mol.

