Questões de Vestibular de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria.
Foram encontradas 622 questões
Um veículo de passeio, movido a gasolina, deixou a capital paulista com o tanque cheio, dirigindo-se a uma cidade do interior situada a 480 km, na região noroeste do estado. Ao final da viagem, verificou-se que o consumo médio do veículo foi de 16 km por litro de combustível.
Admitindo-se que a composição média da gasolina seja dada pela fórmula C8 H18 e que a combustão seja completa, conclui-se que o volume de CO2 , em litros, medido nas CATP e lançado ao ar durante a viagem foi de, aproximadamente,
Dados
Volume molar de gás nas CATP = 25 L / mol
Densidade da gasolina = 8 x 102 g / L
Massas molares em g / mol:
C = 12; H = 1 e O = 16
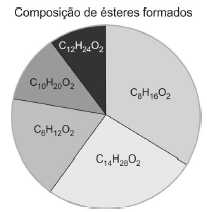
O ácido carboxílico presente em maior quantidade na amostra analisada é o:
Um certo polímero é produzido a partir de um monômero, que é um hidrocarboneto que contém somente uma instauração. A análise elementar por combustão completa de 0,5 mol de moléculas desse hidrocarboneto resultou em 1,5 mol de moléculas de CO2 .
A massa molar, em g.mol–1 , desse monômero é
A bioluminescência é o fenômeno de emissão de luz visível por certos organismos vivos, resultante de uma reação química entre uma substância sintetizada pelo próprio organismo(luciferina) e oxigênio molecular, na presença de uma enzima (luciferase). Como resultado dessa reaçãobioquímica é gerado um produto em um estado eletronicamenteexcitado (oxiluciferina*). Este produto, por suavez, desativa-se por meio da emissão de luz visível, formandoo produto no estado normal ou fundamental (oxiluciferina).Ao final, a concentração de luciferase permanece constante.

O esquema ilustra o mecanismo geral da reação de bio-luminescência de vagalumes, no qual são formados dois produtos diferentes em estados eletronicamente excitados,responsáveis pela emissão de luz na cor verde ou na cor vermelha.

A luz branca é composta por ondas eletromagnéticas de todas as frequências do espectro visível. O espectro de radiação emitido por um elemento, quando submetido a um arco elétrico ou a altas temperaturas, é descontínuo e apresenta uma de suas linhas com maior intensidade, o que fornece “uma impressão digital” desse elemento. Quando essas linhas estão situadas na região da radiação visível, é possível identificar diferentes elementos químicos por meio dos chamados testes de chama. A tabela apresenta as cores características emitidas por alguns elementos no teste de chama:
Elemento Cor
sódio laranja
potássio violeta
cálcio vermelho-tijolo
cobre azul-esverdeada