Questões de Vestibular
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 335 questões
I. CaC2(s) + N2(g) 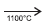 CaNCN(s) + C(s)
CaNCN(s) + C(s)
II. CaNCN(s) + 5H2O(ℓ) → CaCO3(s) + 2NH4OH(aq)
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100ºC, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:

O diagrama representa a entalpia de formação do pentacloreto de fósforo a partir de duas variedades alotrópicas de fósforo, o fósforo branco e o fósforo vermelho.
A partir da análise desse diagrama, é correto afirmar:
A partir da utilização desses modelos de ligação química na compreensão da estrutura molecular de algumas substâncias, é correto afirmar:
O besouro-bombardeiro consegue afastar seus predadores, lançando sobre eles um jato quente e repelente de quinona, substância produzida em seu abdômen, através da reação química entre hidroquinina e peróxido de hidrogênio. O fenômeno pode ser representado pela equação:
C6 H6 O2(aq) + H2O2(aq) → C6 H4O2(aq) + 2H2 O ∆H = –204 kJ/mol
Hidroquinona Quinona
Muitos dos estudos mais antigos sobre as reações do ouro surgiram da prática da alquimia com objetivo de transformar metais nesse elemento químico. Os alquimistas descobriram que o ouro pode ser dissolvido em uma mistura de ácidos clorídrico e nítrico concentrados, na proporção de 3:1, conhecida como água régia, de acordo com a equação química simplificada não balanceada.
Considerando-se essas informações e a partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
I. O produto da reação é um composto iônico. II. O átomo de xenônio perde elétron transformando-se em um cátion. III. O número de prótons do núcleo do átomo de xenônio diminui de uma unidade.
É correto o que se afirma em
I. O cromo é usado para recobrir metais.
II. O 2,2,4-trimetilpentano é usado na constituição da gasolina.
III. O etanol é o principal componente do álcool gel.
São responsáveis pelos estados físicos dessas substâncias, respectivamente,
3 Sb2S3(s) + 11KClO3(s) → 3 Sb2O5(s) + 11 KCl(s) + 9 SO2(g)
Sobre a reação, é correto afirmar que
Com base nessas informações, é correto afirmar que:
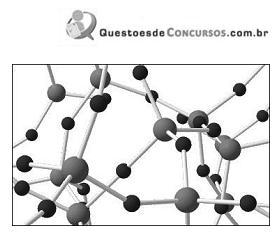
A substância representada por esse modelo tridimensional pode ser
I. Cátions são íons de carga positiva.
II. Ligações iônicas são formadas pelo compartilhamento de elétrons.
III. O Potencial de ionização nos elementos da família 1A é diretamente proporcional ao raio atômico.
IV. Uma ligação covalente é exclusivamente uma ligação π (pi).
V. Elementos com distribuição eletrônica final em np5 , são por características, doadores de elétrons.
VI. Ligações metálicas são realizadas por todos os elementos representativos.
VII. A formação de um líquido é devido a atrações eletrostáticas entre íons.
VIII. Átomos com hibridização sp2 correspondem a elementos da família 2A da tabela periódica.
IX. Potencial de ionização corresponde à energia necessária para a retirada de um elétron da camada de valência, portanto, é um processo exotérmico.
É CORRETO o que se afirma apenas em:
Analise as alternativas a seguir:
I. Ambos os elementos químicos, carbono e hidrogênio, adquirem estabilidade ao se ligarem covalentemente, pois passam a ter configurações dos gases nobres neônio e hélio, respectivamente.
II. A geometria tetraédrica da molécula de metano é possível ser confirmada pela análise da distribuição eletrônica do carbono no estado fundamental.
III. Para a molécula do metano a substituição de dois átomos de hidrogênio por dois de cloro, através da reação de halogenação de hidrocarbonetos, produz uma mistura de isômeros.
É INCORRETO o que se afirma em:
2NaOH (aq) + Cl2(g) → NaClO(aq) + H2O(1)
Sobre o hipoclorito de sódio e a reação apresentada, é incorreto afirmar que:

A partir das informações do texto, julgue o item seguinte.