Questões de Vestibular
Sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 339 questões


Acerca dos temas tratados no texto, julgue os itens que se
seguem

Com base nessas informações e sabendo que, nas expressões
apresentadas, k é uma constante real a ser determinada, julgue os
itens subseqüentes


Com base nas informações do texto, julgue os itens de 19 a 33.


Com base nas informações do texto, julgue os itens de 19 a 33.


Com base nas informações do texto, julgue os itens de 19 a 33.
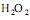 é classificado como um peróxido, pois o módulo do número de oxidação do oxigênio nesse composto é maior que 2.
é classificado como um peróxido, pois o módulo do número de oxidação do oxigênio nesse composto é maior que 2.

Com base nas informações do texto, julgue os itens de 19 a 33.
 é trigonal plana
é trigonal plana
A partir das informações do texto, julgue o item seguinte.




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.
perfeitamente vedada. Mais do que uma cela, tratava-se de um
laboratório. Um homem, jovem, estava sentado, preso em uma
cadeira. Uma grande abertura envidraçada permitia ver tudo. Ao
meio-dia e doze, pequenas bolas de cianeto de potássio (KCN)
caíram em um recipiente sob o assento, onde havia uma mistura
de ácido sulfúrico e água. Imediatamente, o gás envenenado
(HCN) começou a espalhar-se pelo ambiente. O homem começou
a tossir, a sufocar. Em poucos minutos, sua cabeça pendeu.
Tossiu, novamente, mais forte, ergueu a cabeça pela última vez
e desabou. Ao meio-dia e trinta, os médicos que supervisionavam
os instrumentos de controle declararam que o condenado Walter
LaGrands estava clinicamente morto. Ele tinha trinta e sete anos.
Nascera em Augsbourg, na Alemanha, como seu irmão Karl. A
mãe deles casara-se com um soldado americano, destacado para
servir na Alemanha, e depois partiu para os EUA com seus dois
filhos. Em 1982, em uma tentativa de roubo a mão armada a um
banco no Arizona, os irmãos LaGrands mataram um funcionário
e feriram outro. Eles tinham, à época, vinte e dezoito anos.
Ambos foram condenados à pena capital. Passaram dezesseis
anos no corredor da morte. Depois de ter o último recurso
negado, Karl solicitou ser executado com uma injeção letal.
Walter recusou. Era sua última cartada: já que a justiça americana
decidira que ele deveria morrer, que ela, então, matasse esse
cidadão alemão na câmara de gás. Talvez Walter pensasse que a
governadora do Arizona, Jane Hall, ante a dimensão simbólica
desse ato, pudesse recuar. Enganou-se. No dia 3 de março, Walter
foi levado à câmara de gás.
Robert Badinter. Contre la peine de mort. Écrits 1970-2006.
Paris: Fayard, 2006, p. 249-50 (tradução com adaptações).
A partir do texto, considerando os diferentes aspectos que ele
suscita e sabendo que as massas atômicas do hidrogênio, enxofre
e oxigênio são iguais, respectivamente, a 1, 32,1 e 16, julgue os
itens
CH4(g) + 2O2(g) ➜ CO2(g) + 2H2O
Em relação ao metano CH4 e ao dióxido de carbono (CO2) pode-se dizer que a forma geométrica de cada um desses compostos, respectivamente, é
Um dos compostos do chumbo é o Pb3O4 . Em relação a esse composto, pode-se afirmar que
Considere a reação simplificada da síntese do Ácido Acetilsalicílico:
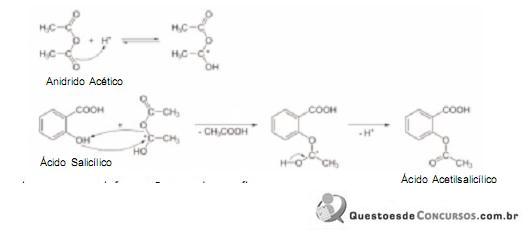
Com base nessas informações, pode-se afirmar que:
I o pH de uma solução 0,0010 M de Ácido Acetilsalicílico é igual a 11,00;
II na reação mostrada, o pH da solução está abaixo de 7,00;
III uma hidrólise no grupo funcional éster do Ácido Acetilsalicilíco com excesso de
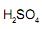 origina uma solução de pH acima de 7,00;
origina uma solução de pH acima de 7,00; IV um isômero do Ácido Salicílico é o Ácido Meta-Hidroxibenzóico;
V na fórmula estrutural do Ácido Acetilsalicílico todos os átomos de Carbono são trigonais planares.
Assinale a opção correta.

Assinale a opção correta.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
I. FeS2 + O2 → Fe2(SO4)3 + SO2
II. Fe2(SO4)3 + H2O → Fe(OH)3 + H2SO4
III. H2SO4 + KNO3 → KHSO4 + HNO3
A partir da leitura do texto e da interpretação das equações, assinale com V ou F, conforme sejam verdadeiras ou falsas, as assertivas abaixo.
( ) A equação I traduz uma reação de deslocamento.
( ) A soma dos coeficientes da equação II é 13.
( ) Na equação III, existe um sal ácido.
( ) Na pirita, o nox do ferro é +2.
( ) Para produzir 94,5 kg de ácido nítrico, são necessários 121,5 kg de salitre.
( ) A equação II traduz uma reação de óxido redução.
A sequência correta, de cima para baixo, é:
Em um Laboratório de Química Orgânica existem diversas substâncias químicas, como metanol, acetato de etila, trietilamina e acetato de sódio. Considerando essas quatro substâncias, analise as proposições.
I. A trietilamina não realiza ligações de hidrogênio entre suas moléculas.
II. O acetato de sódio apresenta somente ligações covalentes polares.
III. O acetato de etila é um éter e apresenta ligações covalentes polares.
IV. O metanol apresenta ligações covalentes polares e não realiza ligações de hidrogênio entre suas moléculas.
V. As quatro substâncias apresentam somente ligações covalentes polares e apolares.
Assinale a alternativa correta.
O efeito estufa é um processo natural que ocorre na atmosfera, garantindo o aquecimento da superfície da Terra por meio da absorção de energia pelos gases do efeito estufa. Esse processo natural garante que a superfície terrestre tenha uma temperatura média de 15ºC. Porém, atividades antrópicas têm contribuído para o aumento desses gases do efeito estufa, levando a um maior aquecimento do Planeta. Dentre os gases do efeito estufa, o dióxido de carbono, o metano e o monóxido de dinitrogênio estão entre os principais responsáveis.
Assinale a alternativa que apresenta a geometria das seguintes moléculas: dióxido de carbono, metano e monóxido de dinitrogênio, sequencialmente.
O elemento químico arsênio (As) é um metaloide encontrado naturalmente no meio ambiente, sendo as erupções vulcânicas uma de suas principais fontes. Dentre os diversos minerais que contêm arsênio, a arsenopirita (FeAsS) é o mais comum. Esse elemento também pode ser encontrado em alimentos como peixes e crustáceos, e também na cerveja e no vinho branco. Porém, a maior contaminação no homem ocorre por ingestão de água contaminada. Compostos de arsênio foram amplamente utilizados na agricultura como pesticidas. No ramo da medicina veterinária é utilizado como antiparasitário e como aditivo em ração animal. Seu uso também está presente nas indústrias de eletrônicos, como clarificador de vidros e na conservação da madeira.
Analise as afirmativas em relação às informações, no quadro acima.
I. O elemento arsênio pode apresentar estados de oxidação +3 e -3.
II. O raio atômico do elemento arsênio é maior do que o elemento alumínio.
III. O elemento arsênio pode realizar três ou cinco ligações covalentes.
Assinale a alternativa correta.
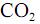 e
e 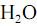 . Indique, por meio de setas, os momentos dipolares de cada ligação química e o momento dipolar resultante de cada molécula. Identifique cada molécula como polar ou apolar.
. Indique, por meio de setas, os momentos dipolares de cada ligação química e o momento dipolar resultante de cada molécula. Identifique cada molécula como polar ou apolar.