Questões de Vestibular
Sobre propriedades físicas dos compostos orgânicos: polaridade das ligações e moléculas, forças intermoleculares, ponto de fusão e ponto de ebulição, solubilização das substâncias orgânicas. em química
Foram encontradas 241 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:

DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
Texto I:
Matar ou morrer
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:
TABELA - Características físicas e químicas da Deltametrina
Estado físico pó cristalino
Cor sem cor
Odor sem odor
Densidade (20 ºC) 0,5 g/cm3
Massa Molar 505,24 g/mol
Ponto de fusão 98 – 101 ºC
Ponto de ebulição acima de 300 ºC
Solubilidade em água (20 ºC) < 0,002 mg/L
Solubilidade em solventes orgânicos Solúvel
Solubilidade em Acetona 500 g/L
FONTE: WHO - WORLD HEALTH ORGANIZATION. Environmental Health Criteria 97 – Deltamethrin. Geneva: International Program on Chemical Safety - IPCS, 1990.
A formula estrutural da Deltametrina é apresentada na figura abaixo:

Comumente, a indústria química comercializa o inseticida Deltametrina com as seguintes especificações:
cada 1000 mL contém:
Deltametrina..............25 g
Veículo q.s.p.............1000 mL
No rótulo desse produto há também recomendações para dilução em água para sua aplicação final, de acordo com a tabela abaixo.
Quantidade de água Moscas Insetos rasteiros
1 litro 6 mL 8 mL
10 litros 60 mL 80 mL
20 litros 120 mL 160 mL
Responda a questão com base nas informações dadas sobre o tema “inseticidas” e em seus conhecimentos
de química.
Texto I:
Matar ou morrer
Ao longo dos anos, tem-se tornado cada vez mais necessário aumentar a produtividade agrícola, visando à produção de alimentos. Já nos ambientes urbanos, o controle dos diversos tipos de pragas e insetos é fundamental para a garantia da saúde pública. Para esses fins, passou-se a utilizar, cada vez mais, não só fertilizantes, como também pesticidas, incluindo os inseticidas, herbicidas e fungicidas. Dentre os inseticidas, a Deltametrina é amplamente utilizada no controle de pragas de diversas culturas, no combate de insetos domésticos, dentre outros. O amplo uso da Deltametrina justifica-se por sua potente ação inseticida, toxicidade relativamente baixa em mamíferos e persistência limitada no meio ambiente. Algumas de suas características físicas e químicas estão listadas na tabela abaixo:
TABELA - Características físicas e químicas da Deltametrina
Estado físico pó cristalino
Cor sem cor
Odor sem odor
Densidade (20 ºC) 0,5 g/cm3
Massa Molar 505,24 g/mol
Ponto de fusão 98 – 101 ºC
Ponto de ebulição acima de 300 ºC
Solubilidade em água (20 ºC) < 0,002 mg/L
Solubilidade em solventes orgânicos Solúvel
Solubilidade em Acetona 500 g/L
FONTE: WHO - WORLD HEALTH ORGANIZATION. Environmental Health Criteria 97 – Deltamethrin. Geneva: International Program on Chemical Safety - IPCS, 1990.
A formula estrutural da Deltametrina é apresentada na figura abaixo:

Comumente, a indústria química comercializa o inseticida Deltametrina com as seguintes especificações:
cada 1000 mL contém:
Deltametrina..............25 g
Veículo q.s.p.............1000 mL
No rótulo desse produto há também recomendações para dilução em água para sua aplicação final, de acordo com a tabela abaixo.
Quantidade de água Moscas Insetos rasteiros
1 litro 6 mL 8 mL
10 litros 60 mL 80 mL
20 litros 120 mL 160 mL
Responda a questão com base nas informações dadas sobre o tema “inseticidas” e em seus conhecimentos
de química.
I - O uso da água como solvente para diluição do inseticida Deltametrina, citado no texto I, tem a vantagem econômica de ser barata e acessível. No entanto, o inseticida não formará uma solução em água, dada sua baixa solubilidade nesse meio. II - Utilizando-se a acetona como solvente tem-se a vantagem desta dissolver bem a Deltametrina, de modo a formar uma solução. No entanto, a acetona, além de ser bem mais cara que a água, também é inflamável. Portanto, por questões econômicas e de segurança, o uso desse solvente é não recomendável para diluição do inseticida. III - A Deltametrina mata os insetos principalmente pelo seu mau cheiro, o que provoca sufocamento nos mesmos.
Está(ão) correta(s) a(s) afirmativa(s):


O quadro a seguir mostra algumas substâncias e seus respectivos pontos de ebulição:
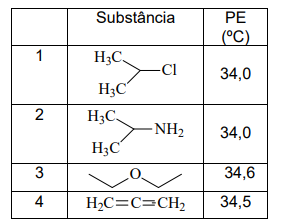
Com base na estrutura e propriedades
destas substâncias, assinale a alternativa
correta.
As propriedades físicas e as estruturas do m-cresol(I), cumeno (II) e naftaleno (III) são dadas a seguir:
Densidade g/cm3 Solubilidade g/100 de água Temperatura ebulição ºC
I 1,03 2,35 203
II 0,86 Insolúvel 153
III 1,14 0,03 218
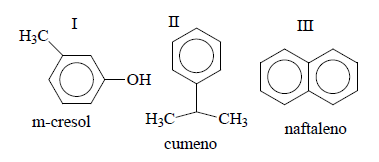
Em relação a propriedades e estruturas
destes compostos, assinale a alternativa
incorreta:
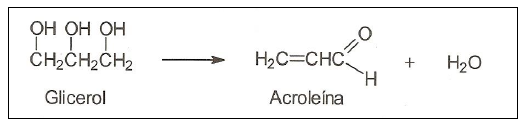 Figura 2: Reação de formação da acroleína
Figura 2: Reação de formação da acroleína Sobre a reação apresentada, assinale a opção INCORRETA.
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
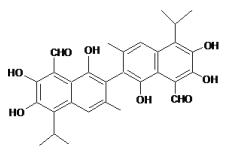 I – A fórmula molecular do gossipol é C30H30O8.
II – A estrutura apresenta os grupos funcionais característicos das funções álcool, aldeído e cetona
III – O gossipol pode se apresentar sob a forma de mistura racêmica.
IV – A acidez dos hidrogênios das hidroxilas ligadas aos anéis aromáticos é equivalente à acidez dos
hidrogênios da hidroxila presente no metanol.
V – Considerando-se as interações intermoleculares características dos compostos orgânicos, o gossipol
apresenta interações intermoleculares relativamente fortes.
Estão CORRETAS as alternativas:
I – A fórmula molecular do gossipol é C30H30O8.
II – A estrutura apresenta os grupos funcionais característicos das funções álcool, aldeído e cetona
III – O gossipol pode se apresentar sob a forma de mistura racêmica.
IV – A acidez dos hidrogênios das hidroxilas ligadas aos anéis aromáticos é equivalente à acidez dos
hidrogênios da hidroxila presente no metanol.
V – Considerando-se as interações intermoleculares características dos compostos orgânicos, o gossipol
apresenta interações intermoleculares relativamente fortes.
Estão CORRETAS as alternativas: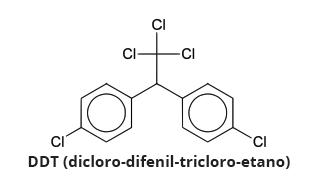 Fonte: CARSON, Rachel. Primavera Silenciosa. São Paulo: Editora Melhoramentos, 1969.
Fonte: CARSON, Rachel. Primavera Silenciosa. São Paulo: Editora Melhoramentos, 1969.Os efeitos maléficos em gerações que fi zeram o uso do produto e em gerações futuras são devidos:
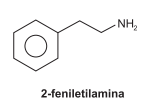
A 2-feniletilamina, representada pela fórmula estrutural, é um neurotransmissor que provoca sensações de “estar enamorado”. Essa substância é também encontrada no chocolate, mas sua ingestão não produz esse tipo de sensação.
A análise da fórmula estrutural de 2-feniletilamina permite
corretamente afirmar:
Substâncias Ponto de fusão (ºC) Ponto de ebulição (ºC) Pentano -130 36 Éter etílico -116 34
Assinale alternativa que apresenta a resposta correta para quando a temperatura registrada em Querência for de 34 ºC.
Propano, CH3CH2CH3 44 -42 Metoximetano, CH3OCH3 46 -25 Etanol, CH3CH2OH 46 78 Butano, CH3(CH2)2CH3 58 -1
As forças das interações intermoleculares são responsáveis por manter os estados de agregação nos líquidos e nos sólidos moleculares, além de influir sobre a diferença de temperatura de ebulição entre essas substâncias. Embora a intensidade das interações intermoleculares represente um fator preponderante, o tamanho da molécula também influi sobre a temperatura de ebulição dessas substâncias.
A tabela apresenta as massas moleculares e os pontos de ebulição de algumas substâncias moleculares.
A partir dessas informações e da análise desses dados da tabela, é correto afirmar:
Clorofórmio, CHCl3 -63 61 Etoxietano, CH3 CH2 OCH2 CH3 -116 34 Etanol, CH3 CH2 OH -117 78 Fenol, C6 H5 OH 41 182 Pentano, CH3 (CH2)3 CH3 -130 36
A partir da análise dos dados dessa tabela, que apresenta as propriedades físicas de algumas substâncias químicas, é correto afirmar:
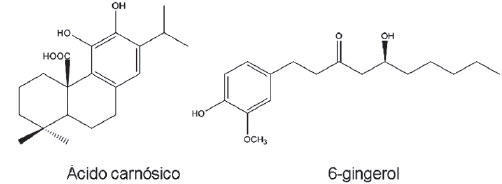
Os recursos naturais continuam sendo importantes fontes de substâncias e precursores com grande potencial terapêutico, não apenas pelo grande número de espécies vegetais com propriedades medicinais inexploradas, mas principalmente pela variedade de metabólitos primários e secundários por elas sintetizados. Os principais compostos antioxidantes extraídos do alecrim e do gengibre são o ácido carnósico e o 6-gingerol, respectivamente, conforme estrutura química.
Sobre a química dessas substâncias, é correto afirmar:

