Questões de Vestibular Comentadas sobre química
Foram encontradas 1.411 questões
O valor de pH quando o volume titulante adicionado for 1.00% maior do que o volume necessário para que o ponto de equivalência seja alcançado é
Uma amostra de CaCl2 impura foi dissolvida e titulada com solução de AgNO3 :
CaCl2 + 2AgNO3 → Ca(NO3 )2 + 2AgCl
Determinou-se que 46.35 mL de uma solução de AgNO3 0.1034 M titulam uma amostra de CaCl2 de massa 0.2843 g.
O percentual de CaCl2
na amostra é
Existem quatro números quânticos: número quântico principal; número quântico de momento angular ou azimutal (secundário); número quântico magnético e número quântico de spin. Esses quatro números quânticos, além de se complementarem, nos permitem fazer uma descrição completa dos elétrons nos átomos, pois eles representam o nível principal de energia do elétron, o subnível de energia, a orientação espacial da nuvem eletrônica e a orientação do próprio elétron na nuvem.
Considerando as informações, dentre as seguintes séries de números quânticos abaixo, aquela que descreve corretamente um elétron em um dado átomo é:

Como é possível observar, as ligações duplas presentes nos átomos de carbono 9 e 12 afetam o formato espacial da molécula.
As conformações espaciais nessas ligações duplas são denominadas, respectivamente:
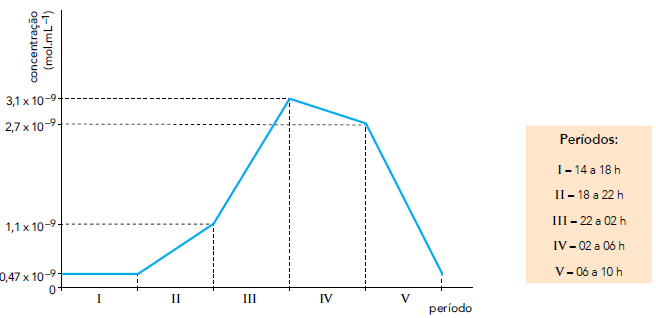 A maior taxa de produção do hormônio, em mol.mL–1.h–1, verificada em um dos cinco períodos
do exame, corresponde a:
A maior taxa de produção do hormônio, em mol.mL–1.h–1, verificada em um dos cinco períodos
do exame, corresponde a:

Em análises químicas, o carbono orgânico total é uma grandeza que expressa a concentração de carbono de origem orgânica em uma amostra.
Assim, com base nos dados da tabela, a concentração de carbono orgânico total na amostra de água examinada, em mg/L, é igual a:
Considere o processo de dissolução de sulfato ferroso em água, no qual ocorre a dissociação desse sal.
Após esse processo, ao se aplicar um campo elétrico, o seguinte íon salino irá migrar no sentido do polo positivo:

Nas últimas décadas, o dióxido de enxofre (SO2 ) tem sido o principal contaminante atmosférico que afeta a distribuição de liquens em áreas urbanas e industriais. Os liquens absorvem o dióxido de enxofre e, havendo repetidas exposições a esse poluente, eles acumulam altos níveis de sulfatos (SO42– ) e bissulfatos (HSO4– ), o que incapacita os constituintes dos liquens de realizarem funções vitais, como fotossíntese, respiração e, em alguns casos, fixação de nitrogênio.
(Rubén Lijteroff et al. Revista Internacional de contaminación ambiental, maio de 2009. Adaptado.)
Nessa transformação do dióxido de enxofre em sulfatos e bissulfatos, o número de oxidação do elemento enxofre varia de _______ para ______ , portanto, sofre __________.
As lacunas desse texto são, correta e respectivamente, preenchidas
por:
A imagem mostra o primeiro avião do mundo movido a etanol (C2 H5 OH), o avião agrícola Ipanema, de fabricação brasileira.

Considere que a velocidade de cruzeiro dessa aeronave seja
220 km/h, que o consumo de combustível nessa velocidade
seja 100 L/h, que cada litro de combustível contenha 0,8 kg
de C2
H5
OH e que a combustão seja completa.
Em um percurso de 110 km, à velocidade de cruzeiro constante,
a massa de dióxido de carbono lançada ao ar devido à
combustão, em kg, é próxima de
Considere uma pulseira formada por 22 esferas de hematita (Fe2 O3 ), cada esfera com raio igual a 0,5 cm.

O fecho e o fio que unem as esferas dessa pulseira têm massas
e volumes desprezíveis e a densidade da hematita é cerca
de 5,0 g/cm3
. Sabendo que o volume de uma esfera é
calculado pela expressão 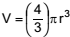 , a massa, em gramas,
dessa pulseira é próxima de
, a massa, em gramas,
dessa pulseira é próxima de
Analise a fórmula que representa a estrutura do iso-octano, um derivado de petróleo componente da gasolina.
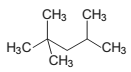
De acordo com a fórmula analisada, é correto afirmar que o
iso-octano
Uma forma de se obter oxigênio em laboratório é pela reação química entre solução aquosa de peróxido de hidrogênio (água oxigenada) e solução aquosa de permanganato de potássio em meio ácido, cuja equação, parcialmente balanceada, é:
xKMnO4(aq) + 3H2SO4(aq) + yH2O2(aq)→
→ K2SO4(aq) + 2MnSO4(aq) + zO2(g) + 8H2O(l)
Nessa equação, os valores dos coeficientes estequiométricos x, y e z são, respectivamente,
O eugenol e o anetol são substâncias aromáticas presentes em óleos essenciais, com aplicações nas indústrias de cosméticos e farmacêutica. O eugenol está presente principalmente nos óleos de cravo, canela e sassafrás, já o anetol é encontrado nos óleos essenciais de anis e anis estrelado.
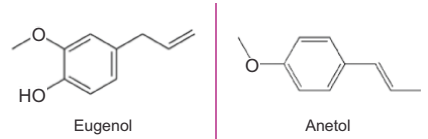
Sobre esses compostos foram feitas as seguintes afirmações.
I. Ambos apresentam isomeria geométrica.
II. O eugenol apresenta funções fenol e éter, enquanto que o anetol apresenta função éter.
III. A fórmula molecular do eugenol é C10H12O2 , enquanto que o anetol apresenta fórmula molecular C10H12O.
IV. O anetol apresenta temperatura de ebulição maior do que o eugenol.
Estão corretas APENAS as afirmações:
A tira tematiza a contribuição da atividade humana para a deterioração do meio ambiente. Do diálogo apresentado, pode-se depreender que os ursos já sabiam

Os compostos (NH4)H2PO4 e NaHCO3 são usados em extintores como agentes de combate ao fogo. Quando lançados sobre uma chama, ocorrem as seguintes transformações:
(NH4)H2PO4 → NH3 + H3PO4
H3PO4 → polifosfato (viscoso)
NaHCO3 → CO2 + H2O + Na2CO3 (particulado).
No combate a todos os tipos de incêndio, a nuvem formada
de gás é importante, mas naqueles envolvendo materiais
sólidos, o depósito do material oriundo da transformação
do agente de combate sobre o combustível tem papel
decisivo. Assim, o agente (NH4)H2PO4 pode substituir o
NaHCO3 em qualquer situação, mas o contrário não é
verdade. Isso permite concluir que no combate ao incêndio
que envolve
A comparação entre as proporções isotópicas de amostras de um mesmo material, que têm a mesma idade, encontradas em diferentes regiões, pode ser utilizada para revelar se elas têm ou não a mesma origem. Se as proporções são iguais, então é possível que tenham a mesma origem, mas se forem diferentes, é certeza que não têm a mesma origem. A tabela a seguir apresenta os dados de algumas amostras de água, incluindo a de um cometa no qual uma sonda pousou recentemente.
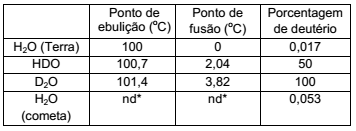
*nd – não disponível
Com base nesses dados, pode-se afirmar corretamente que
a água de nosso planeta