Questões de Vestibular Comentadas sobre química
Foram encontradas 1.427 questões
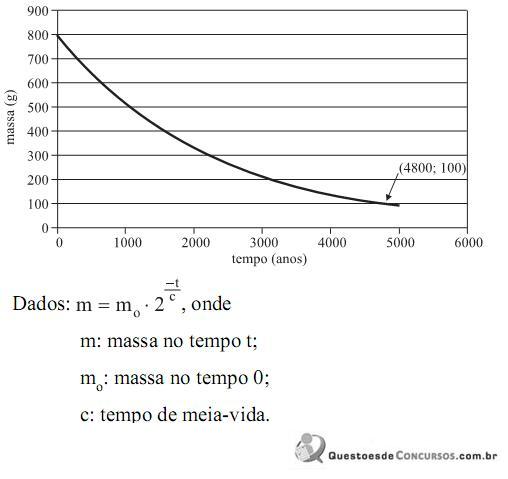
A meia-vida desse isótopo, em anos, é igual a
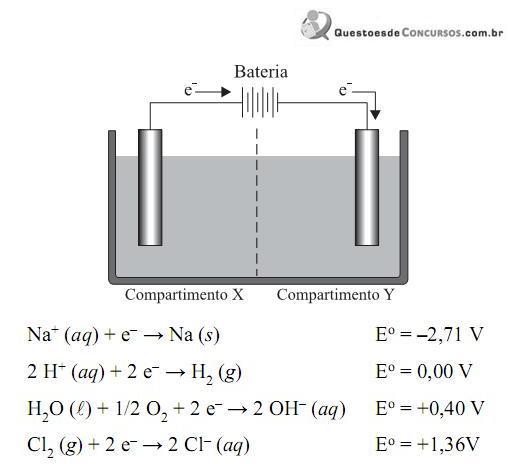
Para essa célula, foram feitas as seguintes afirmações:
I. O pólo positivo é o eletrodo do compartimento Y.
II. O ânodo é o eletrodo do compartimento X.
III. A ddp para a eletrólise de uma solução aquosa de NaCl(aq) é positiva.
IV. Na eletrólise de solução aquosa de NaCl(aq) há formação de gás hidrogênio no eletrodo do compartimento Y.
V. Na eletrólise da solução aquosa de NaCl(aq) há formação de gás cloro no compartimento X.
São corretas somente as afirmações
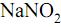 é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.
é um dos aditivos mais utilizados na conservação de alimentos. É um excelente agente antimicrobiano e está presente em quase todos os alimentos industrializados à base de carne, tais como presuntos, mortadelas, salames, entre outros. Alguns estudos indicam que a ingestão deste aditivo pode proporcionar a formação no estômago de ácido nitroso e este desencadear a formação de metabólitos carcinogênicos.Dada a constante de hidrólise:
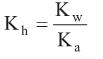
e considerando as constantes de equilíbrio
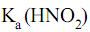 = 5 × 10–4 e
= 5 × 10–4 e 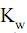 = 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual a
= 1 × 10–14, a 25 oC, o pH de uma solução aquosa de nitrito de sódio 5 × 10–2 mol/L nesta mesma temperatura tem valor aproximadamente igual aT = (A × 2) + 1, onde:
T: teor de álcool na gasolina, e
A: aumento em volume da camada aquosa (álcool e água).
O teste aplicado em uma amostra X de gasolina de um determinado posto indicou o teor de 53%. O volume, em mL, da fase aquosa obtida quando o teste foi realizado corretamente com a amostra X foi
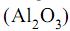 extraído da bauxita para produção de alumínio é aproximadamente igual a
extraído da bauxita para produção de alumínio é aproximadamente igual anúmeros 80 e 81.
O azeite de oliva é considerado o óleo vegetal com sabor e
aroma mais refinados. Acredita-se que ele diminui os níveis
de colesterol no sangue, reduzindo os riscos de doenças car-
díacas. Suspeita-se que algumas empresas misturem óleos de
amendoim, milho, soja e outros, mais baratos, com o azeite
de oliva, para aumentar seus lucros. Os triglicerídeos dife-
rem uns dos outros em relação aos tipos de ácidos graxos e à
localização no glicerol. Quando um triglicerídeo é formado
a partir de dois ácidos linoléicos e um ácido oléico, temos o
triglicerídeo LLO. No azeite de oliva, há predominância do
OOO e no óleo de soja, do LLL. Como os triglicerídeos são
característicos de cada tipo de óleo, sua separação e iden-
tificação tornam possível a análise para detectar possíveis
adulterações do azeite.

Na tabela, são apresentados os ácidos graxos mais comuns.

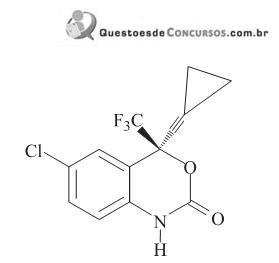
O número de ligações
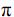 (pi) entre átomos de carbono na molécula do Efavirenz e o nome da principal força de interação que pode ocorrer entre o grupo NH do medicamento e os fluidos aquosos do nosso organismo são, respectivamente,
(pi) entre átomos de carbono na molécula do Efavirenz e o nome da principal força de interação que pode ocorrer entre o grupo NH do medicamento e os fluidos aquosos do nosso organismo são, respectivamente,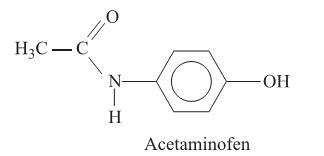
Considere a figura com a estrutura do acetaminofen e as seguintes afirmações:
I. O acetaminofen apresenta fórmula molecular
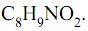
II. O grupo funcional amida é que confere o caráter básico do acetaminofen.
III. A absorção do ácido acetilsalicílico em um indivíduo é maior no estômago do que no intestino, devido ao baixo pH do suco gástrico.
IV. Os fenóis apresentam menor acidez do que os ácidos carboxílicos.
São corretas as afirmações
Para as drogas psicoestimulantes, uma das funções orgânicas apresentadas na estrutura da dietilpropiona e o número de carbonos assimétricos na molécula da fenproporex são, respectivamente,
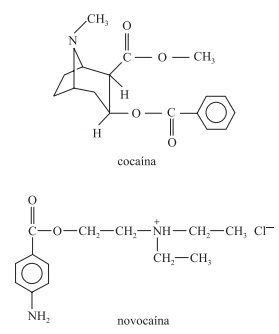
A função orgânica oxigenada encontrada na estrutura da cocaína e o reagente químico que pode ser utilizado para converter o grupo amônio da novocaína da forma de sal para a forma de amina são, respectivamente,

As lacunas do texto podem ser preenchidas corretamente por
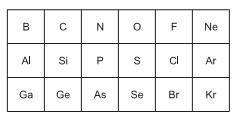
A partir da análise das propriedades dos elementos, está correto afirmar que
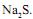 Considerando que a reação química se processa até consumir todo o reagente limitante, quando são transferidos para um recipiente 195 g de sulfeto de sódio, 584 g de ácido clorídrico a 25% em massa e água destilada, a quantidade produzida de sulfeto de hidrogênio, em gramas, é igual a
Considerando que a reação química se processa até consumir todo o reagente limitante, quando são transferidos para um recipiente 195 g de sulfeto de sódio, 584 g de ácido clorídrico a 25% em massa e água destilada, a quantidade produzida de sulfeto de hidrogênio, em gramas, é igual aI. Apresenta massa molar igual a 90,2 g/mol.
II. Apresenta maior pressão de vapor do que a água, nas mesmas condições.
III. É menos densa que o ar, nas mesmas condições.
São corretas as afirmações contidas em
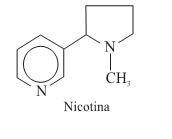
Numa embalagem de cigarros, consta que o produto contém mais de 4700 substâncias tóxicas, sendo relacionados o alcatrão, com 6 mg, o monóxido de carbono, com 8 mg, e a nicotina, com 0,65 mg. Os teores dessas substâncias referem-se à fumaça gerada pela queima de um cigarro. A quantidade em mol de moléculas de nicotina presentes na fumaça de um cigarro dessa embalagem é
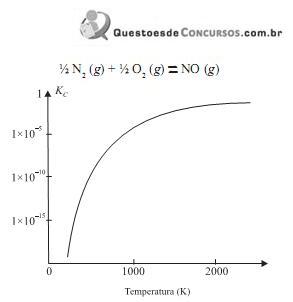
Considere as seguintes afirmações:
I. Um catalisador adequado deslocará o equilíbrio da reação no sentido da conversão do NO em
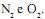
II. O aumento da pressão favorece a formação do NO.
III. A 2400 K há maior quantidade de NO do que a 1200 K. IV. A reação de formação do NO é endotérmica.
São corretas as afirmações contidas somente em