Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
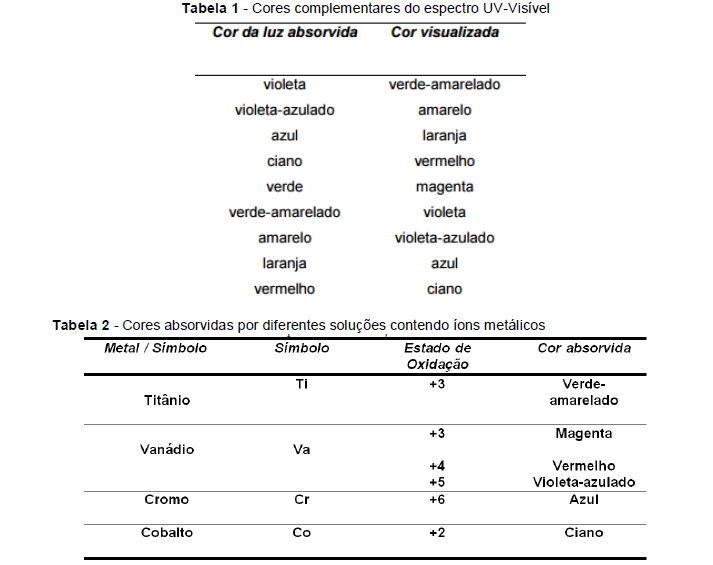
Na dissolução de três compostos metálicos foram visualizadas as seguintes colorações:
Sistema 1 - Violeta Sistema 2 - Ciano Sistema 3 - Laranja
Os íons presentes no sistema 1, 2 e 3 são, respectivamente:
Assinale a alternativa correta.
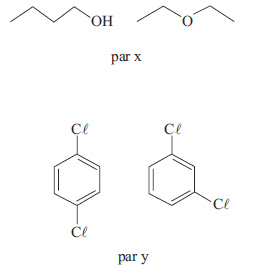
É correto afirmar que os tipos de isomeria encontrada nos pares x e y são, respectivamente,
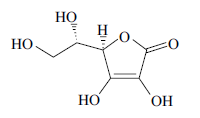
Pode-se afirmar que a vitamina C é um composto
(www.saude.rs.gov.br. Adaptado.)
Para enfrentar tal situação, o governo distribuiu para os hospitais públicos o antiviral tamiflu, que tem como princípio ativo o fosfato de oseltamivir. A estrutura do oseltamivir é representada na figura.
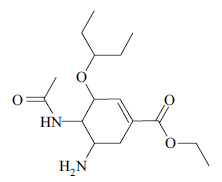
Na estrutura do oseltamivir são encontradas as funções orgânicas
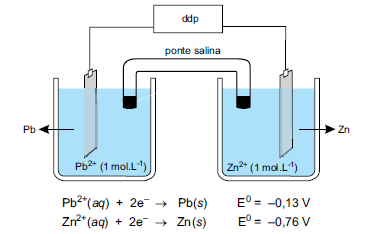
A partir da análise da figura, é correto afirmar que essa pilha tem ddp igual a
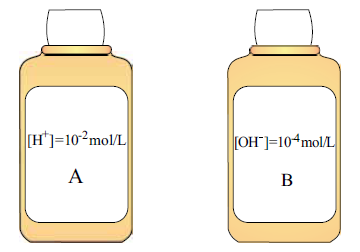
A razão entre os valores de pH da solução B e da solução A, a 25 o C, é
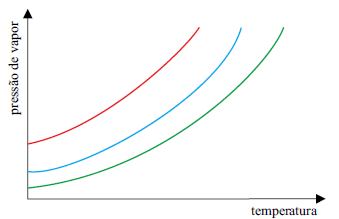
Sobre esses três solventes, é correto afirmar que
Em uma indústria que comercializa gases industriais, um engenheiro elaborou uma lista com os cinco pedidos de compra recebidos num determinado dia de trabalho.
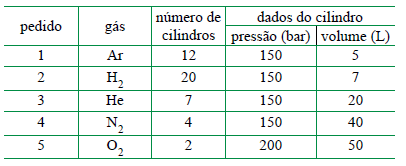
Sabendo que os cilindros rígidos e fechados estão armazenados
na mesma condição de temperatura, o pedido que tem maior
quantidade de matéria, em mol de gás, é o de número
CaF2 (s) + H2SO4 (l) → CaSO4 (s) + 2 HF (g)
Considere que a massa molar do HF seja igual a 20 g·mol–1 e que a massa molar do CaF2 seja igual a 78 g·mol–1 . Se 100 kg de ácido fluorídrico são obtidos a partir de 260 kg de fluorita impura, é correto afirmar que o teor percentual, em massa, de CaF2 nesse minério é
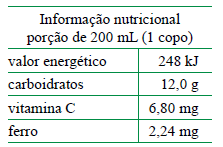
Dada a constante de Avogadro, 6,0 × 1023 mol–1 , é correto afirmar que 1 litro desse suco contém um número total de espécies de ferro, massa molar 56 g·mol–1 , igual a
Com base nesta informação, podemos afirmar que as substâncias adicionais promoverão:
X + NaOH ➡ R-CO2Na + R´-OH ,
qual é a espécie X e a classificação da reação?
Este método torna-se inviável quando se trata de: