Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Em relação às reações inorgânicas em solução, é INCORRETO afirmar que:
A nitroglicerina é um líquido oleoso de cor amarelopálida, e é altamente sensível a choque. O simples ato de balançar o líquido pode causar a explosiva decomposição em gases de nitrogênio, dióxido de carbono, água e oxigênio. Em virtude de a nitroglicerina ser tão instável, é difícil usá-la como um explosivo controlável. O inventor sueco, Alfred Nobel descobriu que a mistura de nitroglicerina com um material sólido absorvente como terra diatomácea ou celulose resulta em explosivo sólido (dinamite), que é muito mais seguro que a nitroglicerina pura.
Sobre o texto acima, é INCORRETO afirmar que:
Disponível em https://www.joiabr.com.br/gem/0706.html. Acesso em: 12 out. 2015.
Sobre o texto acima, é CORRETO afirmar que:
A partir dessas reações, qual a massa mínima (em quilograma), por dia, necessária para eliminar todo o SO2 formado? Para isso suponha que o rendimento é de 100% para as reações citadas.
Marque a opção correta:
Sobre a nomenclatura para o Ag2S, temos como nome o:
Disponível em: https://pt.wikipedia.org/wiki/Capsaicina#/media/File:Capsaicin_Formulae.png. Acesso em: 23 abr. 2019.
A respeito do processo de elaboração do spray de pimenta sabe-se que
Disponível em: www.emaisgoias.com.br/ong-leva-postes-de-energia-solar-areas-quilombolas-em-goias. Acesso em: 25 abr. 2019.
O projeto implantado na comunidade Kalunga de São Domingos tem, entre outros objetivos, a ampliação do acesso a fontes de energia elétrica aliados à sustentabilidade. Considerando o exposto, é correto afirmar que:
Disponível em: <sistemas.eel.usp.br/docentes/arquivos/5840556/434/apostila4papelecelulose.pdf> e <portalresiduossolidos.com/reciclagemde-papel-2/>. Acesso em: 15 out. 2018. [Adaptado].
Sobre esse assunto é correto afirmar que
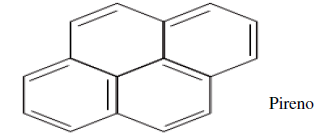
A pirita (FeS2 ) é encontrada na natureza agregada a pequenas quantidades de níquel, cobalto, ouro e cobre. Os cristais de pirita são semelhantes ao ouro e, por isso, são chamados de ouro dos tolos. Esse minério é utilizado industrialmente para a produção de ácido sulfúrico. Essa produção ocorre em várias etapas, sendo que a primeira é a formação do dióxido de enxofre, segundo a equação a seguir.
4 FeS2(s)+ 11 O2(g) → 2 Fe2 O3(s) + 8 SO2(g)
Na segunda etapa, o dióxido de enxofre reage com oxigênio para formar trióxido de enxofre e, por fim, o trióxido de enxofre reage com água, dando origem ao ácido sulfúrico.
Sabendo que o minério de pirita apresenta
92% de pureza, calcule a massa aproximada de
dióxido de enxofre produzida a partir de 200 g
de pirita.
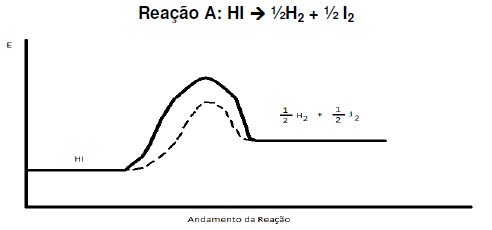
Para que uma reação química aconteça, as moléculas dos reagentes devem colidir com geometria favorável e devem possuir energia suficiente. Se essas duas condições forem atingidas ocorrerá a formação do complexo ativado, o qual corresponde a um estado de transição. Existem vários fatores que influenciam na rapidez das reações, por exemplo, a superfície de contato e a temperatura. O gráfico mostra a variação da energia cinética das moléculas em baixa e alta temperatura. Sobre a influência do aumento da temperatura para a formação do complexo ativado e na rapidez das reações químicas foram feitas as afirmações abaixo
I. Com o aumento da temperatura, um maior número de moléculas irá possuir energia sufi ciente para atingir o estado de ativação.
II. O aumento da temperatura aumenta o número de colisões entre as moléculas dos reagentes e, consequentemente, aumentam os choques não eficazes e os eficazes.
III. Para que ocorra a formação do complexo ativado, as moléculas dos reagentes devem possuir uma quantidade de energia no mínimo igual à energia de ativação e, portanto, o aumento de temperatura favorece a formação do complexo ativado.
IV. A formação do complexo ativado ocorre apenas em reações endotérmicas.
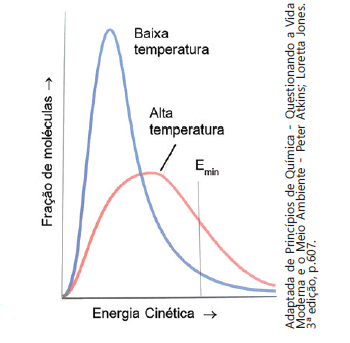
As afirmativas corretas são:
Observe a equação de formação de etanol a seguir:
2 Cgraf + 3 H2(g) + ½ O2(g) → C2 H6 O(l)
Com base nas equações abaixo que resultam na reação de interesse, calcule o ∆H da reação de formação do etanol.
I. Cgraf + O2(g) → CO2(g) ∆H = -394 kJ/mol
II. H2(g) + ½ O2(g) → H2 O(l) ∆H = -286 kJ/mol
III. C2
H6
O(l) + 3 O2(g) → 2 CO2(g) + 3 H2
O(l) ∆H = -1368 kJ/mol
Alguns balões foram preenchidos com diferentes gases. Os gases utilizados foram o hélio, o gás carbônico, o metano e o hidrogênio. A massa molar aparente do ar é 28,96 g/mol e, segundo a Lei de Graham, a velocidade com que um gás atravessa uma membrana é inversamente proporcional à raiz quadrada de sua massa molar.
Assinale a alternativa CORRETA do gás presente no balão que não irá flutuar em ar e do gás presente no balão que muchará primeiro, respectivamente.
A planta Cannabis sativa possui vários componentes canabinoides, sendo que o princípio ativo mais potente é o tetra-hidrocanabinol (THC). Nos últimos anos ocorreu um aumento significativo tanto no interesse quanto na utilização do THC para fins medicinais. A fórmula estrutural do THC está representada a seguir:
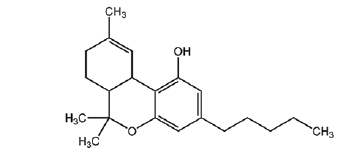
A respeito dessa molécula foram feitas as seguintes observações:
I. Apresenta as funções orgânicas fenol e éster.
II. Possui três radicais metil e 1 radical pentil.
III. Possui três anéis aromáticos condensados.
IV. É uma cadeia insaturada e ramificada.
As afirmativas corretas são:
Examine a estrutura do glutamato monossódico, composto utilizado para realçar o sabor de alimentos.
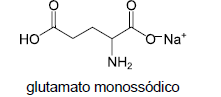
O número de átomos de carbono quiral presente na estrutura
do glutamato monossódico é
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
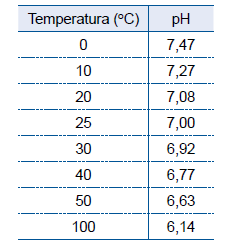
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por: