Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
I. Mistura entre sólido e líquido/ gás, onde são retidas partículas sólidas.
II. Mistura entre líquido-líquido ou sólido-líquido, baseada na separação por densidade – onde as fases permanecem no mesmo recipiente.
III. Mistura entre líquido-líquido ou sólido-líquido, baseada na separação por densidade – um recipiente fica em posição mais elevada que o outro recipiente para o qual é transferida uma das fases.
IV. Mistura entre sólidos, baseada na densidade – utiliza-se a água corrente para carregar sólidos de baixa densidade, enquanto os mais densos permanecem depositados no fundo do recipiente.
Assinale a alternativa que indica correta e sequencialmente os processos de separação de misturas descritos anteriormente:
 H+(aq) + CN-
(aq)
H+(aq) + CN-
(aq)
 H+(aq) + CN-
(aq)
H+(aq) + CN-
(aq)

A questão abaixo se refere à figura acima. O cloreto de
amônio possui fórmula estequiométrica NH4Cl e, na
forma sólida, ele se cristaliza de acordo com uma
estrutura tridimensional, chamada célula unitária, na qual
oito íons cloreto (Cl-
) ocupam os vértices de um cubo, e o
íon amônio (NH4+
) está localizado no centro desse cubo.
Em relação ao íon amônio, o átomo de nitrogênio ocupa
exatamente o centro do cubo, e os átomos de hidrogênio
formam uma figura geométrica cujos vértices se
localizam nas diagonais do cubo. Sabendo que o diâmetro
de um íon Cl-
e a distância entre os centros de dois íons
Cl-
que ocupam as extremidades de uma mesma aresta do
cubo são iguais a 362 picômetros, assinale o que for
correto.

A questão abaixo se refere à figura acima. O cloreto de
amônio possui fórmula estequiométrica NH4Cl e, na
forma sólida, ele se cristaliza de acordo com uma
estrutura tridimensional, chamada célula unitária, na qual
oito íons cloreto (Cl-
) ocupam os vértices de um cubo, e o
íon amônio (NH4+
) está localizado no centro desse cubo.
Em relação ao íon amônio, o átomo de nitrogênio ocupa
exatamente o centro do cubo, e os átomos de hidrogênio
formam uma figura geométrica cujos vértices se
localizam nas diagonais do cubo. Sabendo que o diâmetro
de um íon Cl-
e a distância entre os centros de dois íons
Cl-
que ocupam as extremidades de uma mesma aresta do
cubo são iguais a 362 picômetros, assinale o que for
correto.

A questão abaixo se refere à figura acima. O cloreto de
amônio possui fórmula estequiométrica NH4Cl e, na
forma sólida, ele se cristaliza de acordo com uma
estrutura tridimensional, chamada célula unitária, na qual
oito íons cloreto (Cl-
) ocupam os vértices de um cubo, e o
íon amônio (NH4+
) está localizado no centro desse cubo.
Em relação ao íon amônio, o átomo de nitrogênio ocupa
exatamente o centro do cubo, e os átomos de hidrogênio
formam uma figura geométrica cujos vértices se
localizam nas diagonais do cubo. Sabendo que o diâmetro
de um íon Cl-
e a distância entre os centros de dois íons
Cl-
que ocupam as extremidades de uma mesma aresta do
cubo são iguais a 362 picômetros, assinale o que for
correto.
As reações que acontecem no interior da bateria estão representadas abaixo.
Ânodo: Pb(s) + HSO4-(aq) + H2O(ℓ) → PbSO4(s) + H3O+(aq) + 2e- Cátodo: PbO2(s) + 3H3O+(aq) + HSO4-(aq) + 2e- → PbSO4(s) + 5H2O(ℓ)
A respeito das baterias de chumbo, considere as afirmações I, II, III e IV.
I. A concentração da solução de ácido sulfúrico utilizada na bateria é de aproximadamente 390 g/L. II. Um derramamento da solução de bateria pode ser neutralizado com uma solução de cloreto de amônio. III. Uma solução de bateria pode ser preparada a partir da diluição de 100 mL de ácido sulfúrico, 18 mol/L, com água pura, até volume final de 1 L. IV. A equação Pb(s) + PbO2(s) + 2H3O+(aq) + 2 HSO4-(aq) → 2 PbSO4(s) + 4H2O(ℓ) representa a reação global que ocorre na bateria.
Dado: massa molar do H2SO4 = 98 g/mol.
Dessas afirmações, estão corretas, apenas
N2(g) + 3 H2(g)
Com o intuito de favorecer a produção de amônia, foram feitas, no sistema, as intervenções de I a V.
I. Aumento da pressão total do sistema.
II. Aumento da pressão parcial do gás amônia.
III. Diminuição da concentração do gás hidrogênio.
IV. Aumento da concentração do gás nitrogênio.
V. Utilização de um catalisador de ferro metálico.
São eficientes, para esse propósito, apenas as intervenções
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
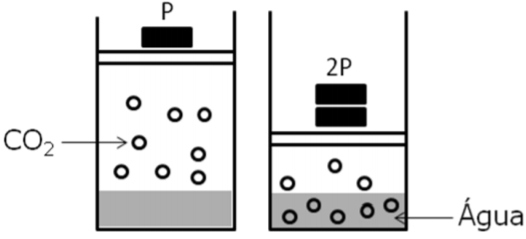
No champanhe, nos vinhos espumantes e nas cervejas, o dióxido de carbono (CO2) é o principal responsável pela formação das bolhas, originadas quando o levedo fermenta os açúcares, convertendo-os em moléculas de álcool e de CO2.
Após o engarrafamento, é estabelecido um equilíbrio entre o gás carbônico dissolvido no líquido e o gás que está no espaço sob a rolha ou a tampa.
Considerando as informações do texto, os seus conhecimentos químicos e a figura dada, é INCORRETO afirmar que
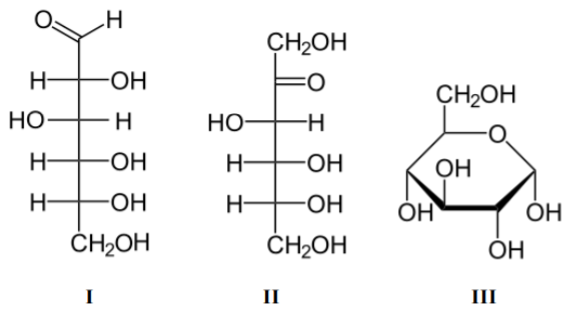
A glicose é um monossacarídeo de grande importância biológica, pois as células a usam como fonte de energia. É um cristal sólido de sabor adocicado, de fórmula molecular C6H12O6, encontrado na natureza na forma livre ou combinada. Juntamente com a frutose, é o carboidrato fundamental na formação do dissacarídeo sacarose. A molécula de glicose pode existir em forma de cadeia aberta ou cíclica, sendo que tais formas permanecem em equilíbrio. Representadas as estrututuras da D-glicose em cadeia aberta (I), D-frutose (II) e D-glicose cíclica (III), respectivamente, é INCORRETO afirmar que