Questões de Vestibular Sobre química
Foram encontradas 6.605 questões
Comparando o óleo mineral, também conhecido como parafina líquida, com um óleo vegetal, como o de soja, pode-se afirmar que ambos são misturas de substâncias químicas _________ e ________. Eles são ________ao ambiente quando descartados nos ralos das pias.
As lacunas do texto são preenchidas por:
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
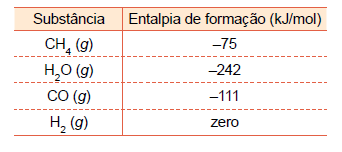
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano
O uso de ácido cítrico no preparo de palmito em conserva é uma das ações necessárias para evitar a sobrevivência da bactéria causadora do botulismo. Em uma das etapas da produção artesanal do palmito, recomenda-se que, antes do envase em potes e do cozimento, os toletes e rodelas sejam imersos em uma “salmoura de espera”, constituída por:
• 5 kg de sal de cozinha,
• 1 kg de ácido cítrico mono-hidratado,
• 100 L de água.
Considerando que o volume da salmoura é igual ao volume de água e que a massa molar do ácido cítrico mono-hidratado é igual a 2 × 102 g/mol, pode-se afirmar que a concentração, em quantidade de matéria de ácido cítrico, nessa salmoura é de, aproximadamente,
Considere as seguintes informações sobre uma liga metálica de bismuto:

As características dessa liga metálica permitem seu uso em
Em relação ao mercúrio (Z=80) e ao texto acima, considere as afirmações I, II, III e IV abaixo.
I. É um elemento químico, cujo número de oxidação é variável, podendo ser, em sua forma iônica, monovalente positivo ou bivalente positivo.
II. É o elemento de símbolo químico Hm.
III. É um não-metal que difere fisicamente dos demais por apresentar-se no estado líquido a 1 atm de pressão e 25º C de temperatura.
IV. É tóxico, tendo efeito cumulativo no organismo humano.
São INCORRETAS, apenas, as afirmações
I. O ferro presente na hematita apresenta número de oxidação igual a +2.
II. De acordo com o processo, para cada mol de hematita adicionada, são utilizados 3 mol de monóxido de carbono.
III. Para um rendimento global igual a 50%, a massa de ferro formada a partir de 1280 kg de hematita é de 448 kg.
IV. O gás carbônico dissolvido em água forma uma solução que apresenta valor de pH maior do que 7.
Dadas as massas molares (g/mol): C = 12, O = 16 e Fe = 56.
Composição química provável (mg/L)
Bicarbonato de sódio 234,35
Carbonato de sódio 9,39
Carbonato de magnésio 6,20
Nitrato de sódio 5,77
pH a 25ºC 8,0
Condutividade elétrica a 25ºC 3,20.10-4 mhos/cm
Temperatura da água na fonte 21,4ºC
I. A água em questão é levemente alcalina.
II. A cada 1 m3 de água evaporada, a 180ºC, ocorrem menos de 200 g de resíduo.
III. Por se tratar de uma substância pura, a água mineral em questão não conduz corrente elétrica.
É correto afirmar que
A respeito de tais elementos é correto afirmar que
Dentre as equações abaixo, assinale a alternativa que representa a síntese do flavorizante de abacaxi.
A respeito dessas substâncias, assinale a alternativa correta.
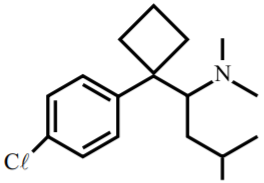
A fórmula estrutural do cloridrato de sibutramina está representada acima e, a respeito da mesma, considere as afirmações:
I. Existe um átomo de carbono terciário com hibridização sp2.
II. Sua fórmula molecular é C17H25NCℓ.
III. Possui 6 elétrons pi ressonantes.
IV. Apresenta os grupos funcionais haleto orgânico e amida.
Estão corretas, somente,
O gráfico abaixo representa a curva de resfriamento de uma substância pura hipotética.
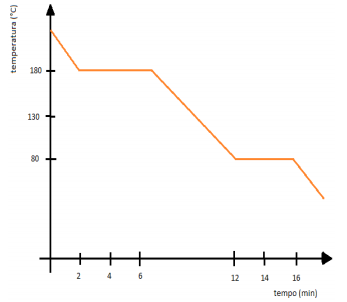
Acerca dos estados físicos e suas transformações, é
correto o que se afirma em:
(Dados das massas atômicas aproximadas: Na = 23u, O = 16u e S = 32u.)
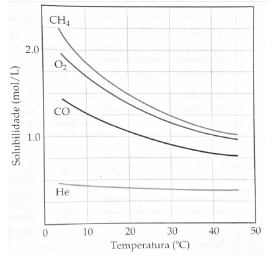
Figura: curva de solubilidade de alguns gases em água com o aumento da temperatura. Disponível em: BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
A respeito dessa curva, é INCORRETO o que se afirma em: