Questões de Vestibular Sobre química
Foram encontradas 6.520 questões
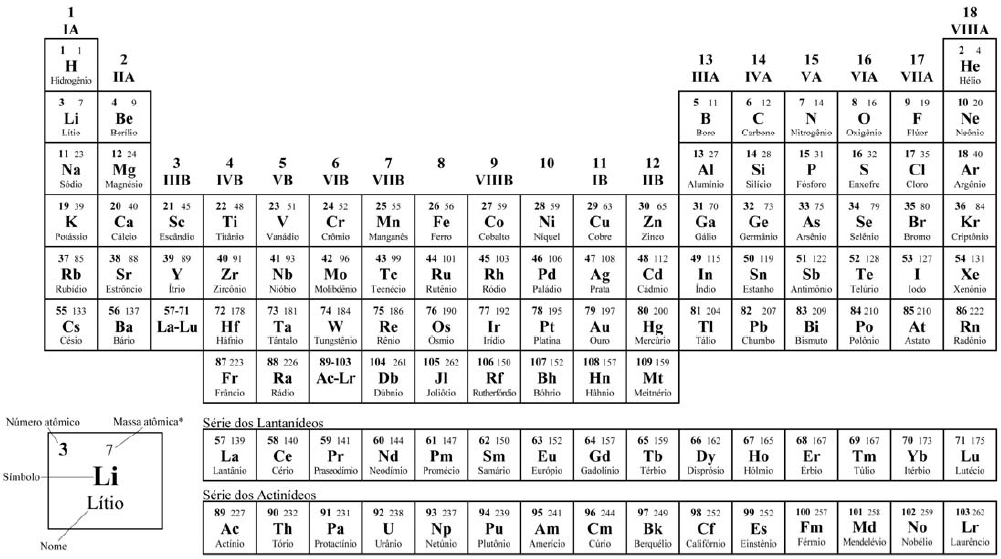
*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADAS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Considerando as afirmações a seguir referentes ao seguinte rol de substâncias: HCl, H2SO4, NaOH, Na2SO4, HCN, CaCl2 e Ca(OH)2, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.

De acordo com os parâmetros atuais de monitoramento ambiental, as águas de superfície não devem conter mais que 0,78 mg/L de cromo. Sabendo-se que a densidade da água pura a 25 °C é 1,0 g/mL, assinale o que for correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.
A questão se refere ao texto a seguir.
Na agricultura, é muito comum a utilização de fertilizantes agrícolas, os quais contêm normalmente três ingredientes principais:
I. Nitrogênio (numa forma combinada, comumente nitrato de amônio ou outros sais de amônio ou ureia);
II. Fósforo (usualmente na forma de fosfatos solúveis);
III. Potássio (na forma de sais, como o sulfato de potássio).
Sobre essas informações, assinale o que for
correto.


representa a curva de aquecimento, sob pressão
de 1,0 atm, em cal × °C de 10,0 g de um material
hipotético. Sobre esse material, assinale o que for
correto.