Questões de Vestibular Sobre química
Foram encontradas 6.605 questões

Adaptado de: <https://www.reddit.com/> . Acesso em: 05 ago. 2019.
O conceito químico, associado a essa tira, pode ser interpretado como
Considere as afirmações abaixo, sobre esse elemento químico.
I - Está localizado no Grupo 10 e no quarto período da tabela periódica. II - Apresenta, em um de seus isótopos, 41 prótons e 52 nêutrons no núcleo atômico. III- Pode ser classificado como um lantanídeo.
Quais estão corretas?
Considere os elementos X, Y e Z da tabela periódica, levando em conta as seguintes afirmações.
1 - X tem 3 elétrons na última camada. 2 - Y tem tendência a formar quatro ligações covalentes. 3 - Z necessita receber dois elétrons para adquirir a configuração de um gás nobre. 4 - Z tem raio atômico semelhante a Y.
Os elementos X, Y e Z são, respectivamente,
éter dimetílico >> etanol > água.
Considere as afirmações abaixo que explicam esse efeito.
I - Deve-se à maior massa molar das substâncias menos voláteis. II - Deve-se à presença de ligações de hidrogênio em maior proporção na água do que no etanol e ausentes no éter dimetílico. III- Deve-se à elevada polaridade do éter.
Quais estão corretas?
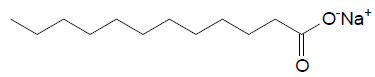
O papel do sabão no processo de limpeza ocorre devido à
Considerando-se a comparação apresentada no enunciado, a presença de eletrosfera é coerente com os modelos atômicos de

Se a solução for resfriada para 20 °C, a massa, em gramas, do sal que irá precipitar será igual a
Dado: R = 0,082 atm.L.Mol-1 .K-1 .
De acordo com os dados apresentados, o composto contido no recipiente é o
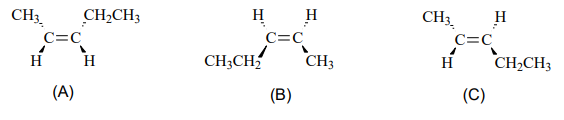
A análise das estruturas químicas apresentadas indica que
4Ag(s) + 2H2S(g) + O2(g)
 2Ag2S(s) + 2H2O(l)
2Ag2S(s) + 2H2O(l)
Nesse processo, o agente redutor é
I. Feijão e casca II. Areia e limalha de ferro III. Serragem e cascalho
Os processos adequados para a separação dessas misturas são, respectivamente:
Dado: MM (KOH) = 56 g.mol-1
De acordo com as informações apresentadas, verifica-se que essa solução apresenta
Dentre os isômeros da molécula do heptano, aquele que apresentará a menor temperatura de ebulição é o
O volume diluído, em mL, da solução estoque, é aproximadamente
A energia produzida, em kcal. mol-1, pela combustão completa de 1000 g de uma mistura de metano e butano na proporção em massa de 2 partes do primeiro para 3 partes do segundo, será aproximadamente
Para o elétron mais energético do átomo de escândio no estado fundamental, os números quânticos principal e secundário são respectivamente
Disponível em: http://agencia.fapesp.br/10461. Acesso em: 30 out. 2013.
Sobre os elementos chumbo (Z=82), cobre (Z=29) e arsênio (Z=33), é correto afirmar que:
Um jovem comprou um produto veterinário para eliminar os carrapatos do seu cachorro. Ao ler a bula, ele tomou conhecimento que o princípio ativo do produto é relativamente tóxico, então ele seguiu as orientações do fabricante para que seu animal de estimação não fosse envenenado. Na bula continha as seguintes informações:
Cada 100 mL contém:
Amitraz .............................................. 12,5 g
Veículo q.s.p. ..................................... 100 mL
O produto deve ser usado da seguinte maneira
Indicação Volume do Produto Volume de água
Eliminação de 2ml 1litro
carrapatos
Considerando que o jovem preparou a solução
em um balde com 5 litros de água, seguindo as
instruções de uso, a concentração final em mg/L do
princípio ativo e o fator de diluição aplicado foram:
De acordo com a sequência citada no texto, marque a opção que apresenta as fórmulas químicas das referidas substâncias.
