Questões de Vestibular
Sobre radioatividade: reações de fissão e fusão nuclear, desintegração radioativa e radioisótopos. em química
Foram encontradas 176 questões
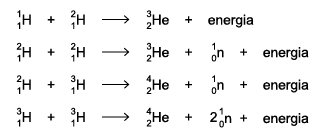
Estima-se que, a cada segundo, 657 milhões de toneladas de hidrogênio estejam produzindo 653 milhões de toneladas de hélio. Supõe-se que a diferença, 4 milhões de toneladas, equivalha à energia liberada e enviada para o espaço.
(Angélica Ambrogi et al. Unidades modulares de química, 1987. Adaptado.)
Sobre a situação apresentada no texto foram feitas três afirmações:
I. A quantidade de energia enviada para o espaço a cada segundo, equivalente a aproximadamente 4 milhões de toneladas de hidrogênio, pode ser estimada pela equação de Einstein, E = mc2 .
II. Todas as reações de fusão nuclear representadas são endotérmicas.
III. No conjunto das equações apresentadas, nota-se a presença de 3 isótopos do hidrogênio e 2 do hélio.
É correto o que se afirma somente em
No que diz respeito aos ciclos de combustíveis nucleares empregados nos reatores, a expressão “fértil” refere-se ao material que produz um nuclídeo físsil após captura de nêutron, sendo que a expressão “físsil” refere-se ao material cuja captura de nêutron é seguida de fissão nuclear.
(José Ribeiro da Costa. Curso de introdução ao estudo dos ciclos de combustível, 1972. Adaptado.)
Assim, o nuclídeo Th-232 é considerado fértil, pois produz nuclídeo físsil, pela sequência de reações nucleares:
232Th + 1n → 233Th → 233Pa + β–
233Pa → nuclídeo físsil + β–
O nuclídeo físsil formado nessa sequência de reações é o
Neste texto, o autor descreve o fascínio que as descobertas em Química exerciam sobre ele, durante sua infância.
Eu adorava Química em parte por ela ser uma ciência de transformações, de inúmeros compostos baseados em algumas dúzias de elementos, eles próprios fixos, invariáveis e eternos. A noção de estabilidade e de invariabilidade dos elementos era psicologicamente crucial para mim, pois eu os via como pontos fixos, como âncoras em um mundo instável. Mas agora, com a radioatividade, chegavam transformações das mais incríveis.
(...)
A radioatividade não alterava as realidades da Química ou a noção de elementos; não abalava a ideia de sua estabilidade e identidade. O que ela fazia era aludir a duas esferas no átomo – uma esfera relativamente superficial e acessível, que governava a reatividade e a combinação química, e uma esfera mais profunda, inacessível a todos os agentes químicos e físicos usuais e suas energias relativamente pequenas, onde qualquer mudança produzia uma alteração fundamental de identidade.
Oliver Sacks, Tio Tungstênio: Memórias de uma infância química.
De acordo com o autor,
A técnica de datação radiológica por carbono-14 permite estimar a idade de um corpo, como o de Lucy, que apresentava 1,2 x 1012 átomos de carbono-14 quando viva.
Essa quantidade, em mols, corresponde a:


O isótopo do elemento césio de número de massa 137 sofre decaimento segundo a equação:
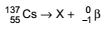
O número atômico do isótopo que X representa é igual a
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
O flúor-18 é um isótopo radioativo artificial muito usado em medicina nuclear. Uma das aplicações se dá no diagnóstico do câncer por meio da fluorodesoxiglicose (FDG) contendo 18F, que é uma versão modificada da molécula de glicose. Sabe-se que as células dos tumores cancerosos apresentam metabolismo mais rápido do que as células normais, por isso absorvem mais glicose do que as demais células. Administrando uma dose de FDG e monitorando onde há maior emissão radioativa, podem-se localizar os tumores no paciente. O flúor-18 apresenta meia-vida de 110 minutos e sofre decaimento radioativo, gerando oxigênio-18, que é estável.
A respeito desse assunto, é correto afirmar:
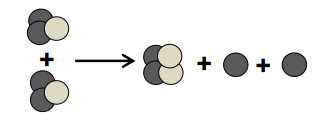
De acordo com esse esquema, pode-se concluir que essa transformação, que liberaria muita energia, é uma
Reatores nucleares não são exclusivamente criações humanas. No período pré✄cambriano, funcionou na região de Oklo, África, durante centenas de milhares de anos, um reator nuclear natural, tendo como combustível um isótopo do urânio.
Para que tal reator nuclear natural pudesse funcionar, seria necessário que a razão entre a quantidade do isótopo físsil(235U) e a do urânio 238U fosse cerca de 3%. Esse é o enriquecimento utilizado na maioria dos reatores nucleares,refrigerados a água, desenvolvidos pelo homem.
O 235U decai mais rapidamente que o 238U; na Terra,atualmente, a fração do isótopo 235U, em relação ao 238U, é cerca de 0,7%. Com base nessas informações e nos dados fornecidos, pode-se estimar que o reator natural tenha estado em operação há
Note e adote: M(t) = M(0)10-λt ; M(t) é a massa de um isótopo radioativo no instante t. λ descreve a probabilidade de desintegração por unidade de tempo.
Para o 238U, λ238 = 0,8 x 10-10 ano-1.
Para o 235U, λ235 = 4,0 x 10-10 ano-1.
log10 (0,23) = – 0,64
A figura foi obtida em uma câmara de nuvens, equipamento
que registra trajetórias deixadas por partículas
eletricamente carregadas. Na figura, são mostradas as
trajetórias dos produtos do decaimento de um isótopo do
hélio 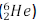 em repouso: um elétron (e-) e um isótopo de lítio
em repouso: um elétron (e-) e um isótopo de lítio
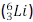 , bem como suas respectivas quantidades de
movimento linear, no instante do decaimento,
representadas, em escala, pelas setas. Uma terceira
partícula, denominada antineutrino (
, bem como suas respectivas quantidades de
movimento linear, no instante do decaimento,
representadas, em escala, pelas setas. Uma terceira
partícula, denominada antineutrino (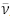 , carga zero), é
também produzida nesse processo.
, carga zero), é
também produzida nesse processo.
O vetor que melhor representa a direção e o sentido da
quantidade de movimento do antineutrino é
Dados:

São conhecidos alguns radioisótopos dos elementos polônio e rádio.
Em um experimento, duas amostras de massas diferentes, uma de polônio-208 e outra de rádio-224, foram mantidas em uma caixa de chumbo por 18 anos. Ao final desse período, verificou-se que a massa de cada um desses radioisótopos presente no recipiente era igual a 0,025 mg.
Sobre esse experimento foram feitas algumas observações:
I. A desintegração β do 224Ra resulta no isótopo 224Pa.
II. A desintegração α do 208Po resulta no isótopo 204Pb.
III. A massa inicial de 224Ra na caixa de chumbo era de 0,200 mg. 208
IV. A massa inicial de 208Po na caixa de chumbo era de 0,150 mg.
Estão corretas apenas as afirmações:
Em linhas gerais, o consumo de água aumentou de forma considerável em todo o planeta ao longo do tempo. Em 1900, o mundo consumia cerca de 580 km³ de água; já em 1950, esse consumo elevou-se para 1400 km³, passando para 4000 km³ em 2000. Segundo previsões da ONU, é provável que em 2025 o nível de consumo eleve-se para 5200 km³. A despeito dessa elevação da utilização da água, registra-se também o aumento do número de pessoas sem fácil acesso à água potável, totalizando 1,1 bilhão em todo o planeta a sofrer com esse problema.
Além da utilização exagerada na área doméstica e no plano individual, soma-se o intensivo consumo de água nas atividades econômicas, notadamente a agricultura e a indústria, isso sem contar o grande volume desperdiçado. Não por acaso, a maior parte do consumo mundial de água acontece nos países desenvolvidos. Os emergentes ou subdesenvolvidos consomem em menor quantidade em razão do menor acesso à água e da menor intensidade das práticas econômicas. Segundo a ONU, o consumo dos países centrais é seis vezes maior do que o consumo dos países periféricos.
Fonte: http://brasilescola.uol.com.br/geografia/consumo-agua-no-mundo.htm
Após 100 horas, a massa dessa amostra, em miligramas, será cerca de:
Foram estudados, independentemente, o comportamento de uma amostra de 100 mg do radioisótopo bismuto-212 e o de uma amostra de 100 mg do radioisótopo bismuto-214. Essas espécies sofrem desintegração radioativa distinta,sendo o bismuto-212 um emissor β, enquanto que o bismuto-214 é um emissor α.
As variações das massas desses radioisótopos foram acompanhadas ao longo dos experimentos. O gráfico a seguir ilustra as observações experimentais obtidas durante as primeiras duas horas de acompanhamento.
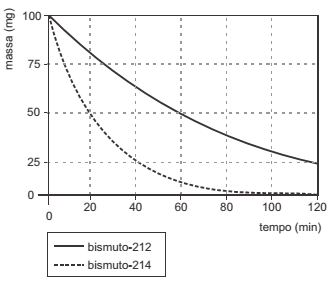
Sobre esse experimento é INCORRETO afirmar que


