Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 230 questões
Em um experimento realizado por Thomas Graham, dois gases A e B foram liberados simultaneamente nas extremidades de um tubo de vidro; esses gases difundiram-se em direção ao centro do tubo e, no instante em que se encontraram, formaram um anel de um composto AB, como mostra a figura a seguir.
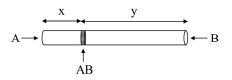
Para esses gases A e B, de massas molares MA e MB, respectivamente, verifica-se o seguinte postulado de Graham, em que vB representa a velocidade de difusão de B e vA, a velocidade de difusão de A.
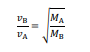
Tendo como referência essas informações e considerando que MA = 4MB, julgue o item.
Nas condições do experimento de Graham, em um tubo de
comprimento igual a 90 cm, o gás B percorrerá uma
distância y superior a 50 cm.

Considere o comportamento dos gases hidrogênio e cloro, respectivamente, em seus balões, nas mesmas condições de temperatura e de pressão.
As informações da imagem retratam o princípio que corresponde à lei de
DADOS QUE PODEM SER USADOS NESTA PROVA

Um estudante de química promoveu algumas reações obtendo os resultados de acordo com a tabela abaixo.
1 vol. de hidrogênio + 1 vol. de cloro → 2 vol. de gás clorídrico
2 vol. de hidrogênio + 1 vol. de oxigênio → 2 vol. de vapor d’água
3 vol. de hidrogênio + 1 vol. de nitrogênio → 2 vol. de amoníaco
Os resultados apresentados ilustram uma lei dos
gases que foi elaborada por
DADOS QUE PODEM SER USADOS NESTA PROVA

Dados: volume interno do cilindro = 50 L; volume aproximado do gás a 1 atm de pressão em cada cilindro = 10 m3 ; pressão inicial no cilindro = ~200 atm.

Considerando que a temperatura ambiente naquele momento era de 30 °C, o motorista certamente precisaria
Dados: T/K = 273 + t/°C; desconsiderar a variação no volume dos pneus; o sensor de pressão não indica variações menores que 1 psi.
Um professor de química fez uma demonstração em que produziu hidrogênio gasoso (H2 ) pela reação, a quente, de ácido clorídrico (HCℓ) com 6,75 g de alumínio sólido (Aℓ) sob forma de folhas amassadas.
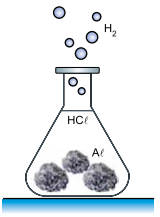
A equação que representa essa reação é:
Aℓ (s) + 3HCl (aq) → AℓCℓ3 (aq) + 3/2H2 (g)
Considere que o hidrogênio seja um gás ideal, que a massa molar do alumínio seja 27 g/mol e que 1 L = 10–3 m3 . Adote para a constante universal do gases o valor R = 8 J/(mol · K). Supondo que todo o gás hidrogênio produzido nessa reação seja armazenado a uma temperatura constante de 27 ºC em um recipiente rígido de volume 10 L, a quantidade de hidrogênio produzida nessas condições ficaria submetida a uma pressão de
Por que o biogás é uma opção de energia renovável?
O biogás é um biocombustível gasoso produzido a partir da decomposição da matéria orgânica por bactérias fermentadoras, em um processo chamado biodegradação anaeróbia, isto é, o processo ocorre na ausência de oxigênio. Nesse processo, produz-se um gás rico em metano (de 40% a 80% de sua composição, sendo o resto dióxido de carbono e pequenas quantidades de hidrogênio, nitrogênio, amônia, ácido sulfídrico, entre outros). Para gerar energia elétrica usando biogás, utiliza-se a conversão da energia química do gás em energia mecânica, por meio de um processo controlado de combustão, que ativa um gerador. O biogás também pode ser purificado para a geração de biometano, que é equivalente ao gás natural veicular.

A tabela a seguir compara as composições químicas médias dos principais componentes do biogás e do biometano.
Gás Principais componentes (% em volume)
Biogás 60% metano; 40% dióxido de carbono
Biometano 95% metano; 5% dióxido de carbono
Quando se comparam volumes iguais de biogás e de biometano sob pressão de 2,0 atm, é possível calcular a diferença:
Pressão parcial de metano no biometano – Pressão parcial de metano no biogás
O valor dessa diferença é
( ) Nos gases ideais, a força de interação entre suas moléculas é desprezível, assim como o volume ocupado pelas suas moléculas. ( ) O volume de um balão contendo 20 g de gás hélio, a uma temperatura de 26°C e pressão de 1,2 x 10³ atm, é 110 L. (Considere: R = 0,082 atm.) ( ) Há gases que a baixas temperaturas e baixas pressões se assemelham em seu comportamento aos gases perfeitos. ( ) Um mol de qualquer gás, à pressão de 1 atm, na temperatura de 273 K, ocupa sempre o volume aproximado de 22,4 L.
A sequência está correta em
Com relação a princípios da química, julgue o próximo item.
Considere que 1 K = 1 ° C + 273, se o ar no interior de um pneu está a 15 ° C sob a pressão de 5 atm, então a pressão será maior que 5,5 atm quando o ar estiver a 38 ° C.
A respeito das substâncias e de suas transformações químicas, julgue o item a seguir.
Mantendo o volume constante, a pressão de um gás ideal aumentará se houver aumento da temperatura.
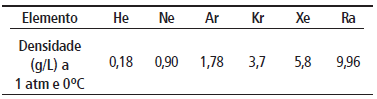
Com base nessas informações e sabendo que a densidade da água é 1 g/cm3 (a 1 atm e 0ºC), analise as assertivas I a III:
I) Num ambiente a 0º C e 1 atm, a densidade do Xenônio (Xe) é maior que a da água. II) A 1 atm e 0º C, 250 mL de Radônio (Ra) tem massa de 2,49 g. III) Num cilindro de êmbulo móvel e sob mesmas condições de temperatura e pressão, 0,3 g de gás Argônio (Ar) ocuparia maior volume que 0,6 g de gás criptônio (Kr).
Estão corretas: