Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 230 questões
 + H2O → 2NH3 + CO2
+ H2O → 2NH3 + CO2
Uma amostra de 30,695g de calcário (carbonato de cálcio) é aquecida a alta temperatura e se decompõe conforme a reação de calcinação
CaCO3(s) —> CaO(s) + CO2(g).
Após um aquecimento vigoroso, o calcário sofreu decomposição completa e depois de resfriado foi pesado e acusou 30,14g. Com base nestas informações, determine o volume de gás liberado na CNTP.
(DADO: C = 12, O = 16 , Ca =40)
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
Dado: Volume de 1 mol de gás na CNTPé 22,4 L
A água oxigenada é o nome dado à solução comercial de peróxido de hidrogênio (H2 O2 ) em água. Em lojas de produtos químicos é possível adquirir frascos contendo água oxigenada 200 volumes. Essa concentração indica que a decomposição total do peróxido de hidrogênio contida em 1,0 L de solução produz 200 L de gás oxigênio medidos na CNTP.
A reação de decomposição da água oxigenada é representada pela equação química a seguir

Desse modo, 50 mL dessa solução contém,
aproximadamente,
Para o exercício, adote os seguintes valores quando necessário:

As unidades de concentração podem ser expressas de diferentes formas. Usualmente utilizamos a concentração comum e o título na maioria dos produtos alimentícios e farmacêuticos. Os cálculos químicos estequimétricos, porém, levam em consideração, preferencialmente, a molaridade.
A água oxigenada, por exemplo, tem sua concentração analisada por uma porcentagem ou pelo volume de oxigênio molecular produzido pela decomposição do peróxido de hidrogênio. Considere a análise de uma solução aquosa com 6 % em massa de peróxido de hidrogênio. A concentração aproximada dessa solução expressa em volume de gás oxigênio formado nas CNTP é de
- Volume molar nas CNPT = 22,4 L.
- Considere que 1 litro de água oxigenada libera 10 litros de gás oxigênio (O2), dessa forma, 10 litros de oxigênio é 10 vezes o volume de 1 litro de água oxigenada, por isso ela é chamada de 10 volumes.
- Considere também que a densidade da água oxigenada em questão é de 1 g.cm-3 .
Uma quantidade equivalente, em mol, de dois gases, nitrogênio e oxigênio, é colocada num recipiente rígido de 2,0 L.
Nesse sistema,
Dado: R = 0,082 atm.L.Mol-1 .K-1 .
De acordo com os dados apresentados, o composto contido no recipiente é o
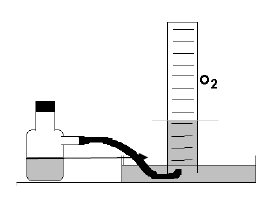
Água oxigenada contém peróxido de hidrogênio (H2O2), que, com o uso de um catalisador, se decompõe, produzindo gás oxigênio e água, conforme a equação abaixo.
H2O2 H2O + ½ O2
Um grupo de estudantes fizeram essa experiência, usando 100 mL de água oxigenada, coletando o gás oxigênio obtido sobre água, conforme ilustrado pela figura, obtendo 1,17 L de gás oxigênio, medidos a uma pressão atmosférica de 0,91atmosferas e a uma temperatura de 20 oC .
Usando a equação PV=nRT, conseguiram determinar o número de mols de O2 obtido e, consequentemente, o número de mols de H2O2 contidos no volume de água oxigenada utilizada. Dessa forma, puderam também determinar a massa deH2O2 contidos nessa água oxigenada. Diante do exposto, pode se concluir que a percentagem m/v (massa volume) deH2O2 na água oxigenada é:
Dados: Constante dos gases ideais R=0,082 atm.L/mol.KK = 273 + t (oC)
Dado: R = 0,082 atm.L.mol-1.K-1 ; considere o hidrogênio um gás ideal.


