Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 237 questões
Assinale a alternativa que melhor representa a variação da pressão (p) exercida pelo gás, em função da variação do volume (V) do recipiente.
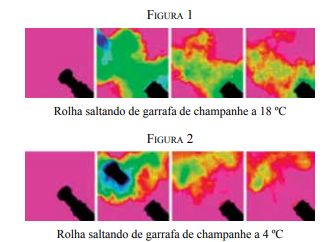
(Pesquisa Fapesp, janeiro de 2013. Adaptado.)
As figuras permitem observar diferenças no espocar de um champanhe: a 18 ºC, logo no início, observa-se que o volume de CO2 disperso na nuvem gasosa – não detectável na faixa da luz visível, mas sim do infravermelho – é muito maior do que quando a temperatura é de 4 ºC. Numa festa de fim de ano, os estudantes utilizaram os dados desse experimento para demonstrar a lei que diz:
A primeira lâmpada comercial, desenvolvida por Thomas Edison, consistia em uma haste de carbono, que era aquecida pela passagem de uma corrente elétrica a ponto de emitir luz visível. Era, portanto, uma lâmpada incandescente, que transforma energia elétrica em energia luminosa e energia térmica. Posteriormente, passou-se a utilizar, no lugar da haste, filamentos de tungstênio, cuja durabilidade é maior. Hoje, esse tipo de lâmpada tem sido substituído pelas lâmpadas fluorescentes e de LED.
As lâmpadas fluorescentes são construídas com tubos de vidro transparente revestidos internamente e contêm dois eletrodos (um em cada ponta) e uma mistura de gases em seu interior — vapor de mercúrio e argônio, por exemplo. Quando a lâmpada fluorescente é ligada, os eletrodos geram corrente elétrica, que, ao passar através da mistura gasosa, excita seus componentes, os quais, então, emitem radiação ultravioleta. O material que reveste o tubo tem a propriedade de converter a radiação ultravioleta em luz visível, que é emitida para o ambiente.
A lâmpada de LED é mais econômica que a incandescente, pois dissipa menos energia em forma de calor. Em geral, essas lâmpadas têm eficiência de 15 lumens por watt. Um lúmen (unidade padrão do Sistema Internacional) é o fluxo luminoso emitido por uma fonte puntiforme com intensidade uniforme de 1 candela e contido em um cone de ângulo sólido de um esferorradiano. A tabela a seguir apresenta características específicas das lâmpadas incandescentes, fluorescentes e de LED.

A partir do texto acima e considerando que 6,63 × 10-34 J-s seja o valor da constante de Planck, que 3 × 108 m/s seja a velocidade da luz e que a temperatura em graus Kelvin seja exatamente igual à temperatura em graus Celsius acrescida de 273, julgue o item.
Considere que o volume disponível para o gás dentro do tubo
de uma lâmpada fluorescente seja independente da temperatura
e que o gás apresente comportamento ideal. Nessas condições,
se, após o acendimento da lâmpada, a temperatura do gás
aumentar de 25 ºC para 2.707 ºC, a pressão do gás será
aumentada em dez vezes.
Um laboratório de controle ambiental recebeu para análise uma amostra de gás sem identificação. Após algumas medidas, foram obtidos os seguintes dados:
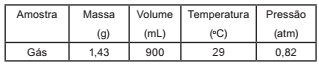
Com base nos valores obtidos, entre os gases indicados
nas opções, conclui-se que a amostra era de:
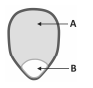
Um grão de milho de pipoca, visto a olho nu, apresenta duas regiões distintas, representadas por A e B na figura. Em A, ocorre o tecido acumulador de amido, usado, pela planta, para nutrir o embrião. Em B, os tecidos vegetais possuem maior teor de água.
Ao ser aquecida, parte da água transforma‐se em vapor, aumentando a pressão interna do grão. Quando a temperatura atinge 177°C, a pressão se torna suficiente para romper o grão, que vira uma pipoca.
Um estudo feito por um grupo de pesquisadores determinou que o interior do grão tem 4,5 mg de água da qual, no momento imediatamente anterior ao seu rompimento, apenas 9% está na fase vapor, atuando como um gás ideal e ocupando 0,1 mL. Dessa forma, foi possível calcular a pressão Pfinal no momento imediatamente anterior ao rompimento do grão.
A associação correta entre região do milho e Pfinal é dada por:
Note e adote:
Constante universal dos gases: R = 0,082 L.atm/(K.mol); K = °C + 273;
Massas molares (g/mol): H = 1; O = 16.
O Halotano, C2HBrClF3 , é um gás não inflamável, não explosivo, e não irritante que é geralmente usado como anestésico, por inalação. Suponha que se faça a mistura de 15.0 g de vapor de Halotano com 23.5 g do gás oxigênio sendo que a pressão total da mistura seja igual a 855 mmHg.
Nas condições apresentadas as pressões parciais do halotano e do oxigênio na mistura serão, respectivamente:
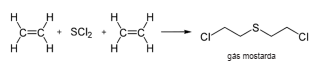
A partir da reação abaixo o volume aproximado, em metros cúbicos de etileno (d=1.18 kg/m3 ), necessário para preparar 2.0 toneladas de gás mostarda é:
Novas tecnologias de embalagens visam a aumentar o prazo de validade dos alimentos, reduzindo sua deterioração e mantendo a qualidade do produto comercializado. Essas embalagens podem ser classificadas em Embalagens de Atmosfera Modificada Tradicionais (MAP) e Embalagens de Atmosfera Modificada em Equilíbrio (EMAP). As MAP são embalagens fechadas que podem utilizar em seu interior tanto gases como He, Ne, Ar e Kr, quanto composições de CO2 e O2 em proporções adequadas. As EMAP também podem utilizar uma atmosfera modificada formada por CO2 e O2 e apresentam microperfurações na sua superfície, conforme ilustrado abaixo.

Adaptado de exclusive.multibriefs.com
Admita que, imediatamente após a colocação do gás argônio em uma embalagem específica, esse gás assume o comportamento de um gás ideal e apresenta as seguintes características:
Pressão = 1 atm
Temperatura = 300 K
Massa = 0,16 g
Nessas condições, o volume, em mililitros, ocupado pelo gás na embalagem é:
Quatro balões esféricos são preenchidos isotermicamente com igual número de mols de um gás ideal. A temperatura do gás é a mesma nos balões, que apresentam as seguintes medidas de raio:
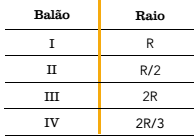
A pressão do gás é maior no balão de número:
Dois balões idênticos são confeccionados com o mesmo material e apresentam volumes iguais. As massas de seus respectivos conteúdos, gás hélio e gás metano, também são iguais. Quando os balões são soltos, eles alcançam, com temperaturas internas idênticas, a mesma altura na atmosfera.
Admitindo-se comportamento ideal para os dois gases, a razão entre a pressão no interior do balão contendo hélio e a do balão contendo metano é igual a:
Uma amostra de 30,695g de calcário (carbonato de cálcio) é aquecida a alta temperatura e se decompõe conforme a reação de calcinação
CaCO3(s) —> CaO(s) + CO2(g).
Após um aquecimento vigoroso, o calcário sofreu decomposição completa e depois de resfriado foi pesado e acusou 30,14g. Com base nestas informações, determine o volume de gás liberado na CNTP.
(DADO: C = 12, O = 16 , Ca =40)
O airbag é um equipamento de segurança na forma de bolsas infláveis que protege os ocupantes de veículos em caso de acidente e tem como princípio fundamental reações químicas. Esse dispositivo é constituído de pastilhas contendo azida de sódio e nitrato de potássio, que são acionadas quando a unidade de controle eletrônico envia um sinal elétrico para o ignitor do gerador de gás. A reação de decomposição da azida de sódio (NaN3) ocorre a 300 °C e é instantânea, mais rápida que um piscar de olhos, cerca de 20 milésimos de segundo, e desencadeia a formação de sódio metálico e nitrogênio molecular, que rapidamente inflam o balão do airbag. O nitrogênio formado na reação é um gás inerte, não traz nenhum dano à saúde, mas o sódio metálico é indesejável. Como é muito reativo, acaba se combinando com o nitrato de potássio, formando mais nitrogênio gasoso e óxidos de sódio e potássio, segundo as reações a seguir:
NaN3 → Na + N2
Na + KNO3 → K2O + Na2O + N2
Considerando uma pastilha de 150 g de azida de sódio com 90% de pureza, o volume aproximado de gás nitrogênio produzido nas condições ambientes é de:
Dados: Volume molar de gás nas condições ambientes = 25 L/mol e massa molar do NaN3 = 65 g/mol.
Analise a questão abaixo.
Reações no estado gasoso com Δn>0 apresentam ΔS>0.