Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 230 questões

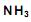 produzido a partir de 28 kg de
produzido a partir de 28 kg de 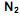 é:
é: 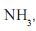 , dióxido de carbono,
, dióxido de carbono, 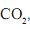 , e hélio, He, são gases.
, e hélio, He, são gases.Considerando-se as características de cada uma dessas substâncias, assinale a alternativa em que a apresentação dos três gases, segundo a ordem crescente de sua solubilidade em água líquida, está CORRETA.
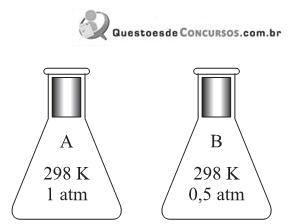
Sobre esses gases, são feitas as seguintes afirmações:
I. O frasco A apresenta o dobro de moléculas em relação ao frasco B.
II. O número de átomos do frasco B é o dobro do número de átomos do frasco A.
III. Ambos os frascos, A e B, apresentam a mesma massa.
IV. Considerando que a reação ocorreu por completo, o frasco C ainda contém gás oxigênio.
São corretas as afirmações
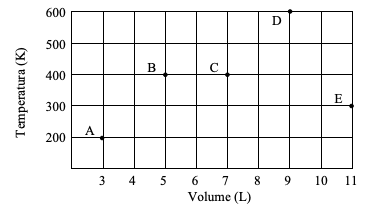
Considere essa massa de gás experimentando as seguintes transformações:
I - Estado inicial: A; Estado final: B. II - Estado inicial: A; Estado final: C. III - Estado inicial: A; Estado final: D. IV - Estado inicial: B; Estado final: D. V - Estado inicial: E; Estado final: A.
Assinale a transformação isobárica.
I. Apresenta massa molar igual a 90,2 g/mol.
II. Apresenta maior pressão de vapor do que a água, nas mesmas condições.
III. É menos densa que o ar, nas mesmas condições.
São corretas as afirmações contidas em
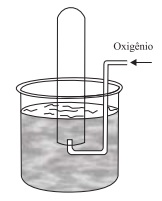
Quando o nível da água dentro do tubo de ensaio é o mesmo que o nível de fora, a pressão no interior do tubo é de 0,86 atm. Dadas a pressão de vapor (H2O) a 27 °C = 0,040 atm e R = 0,082 atm·L·K–1 ·mol –1 , o volume de gás, em mL, dentro do tubo de ensaio é igual a

A ordem decrescente de velocidade de efusão das substâncias contidas nos balões é:

