Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 230 questões
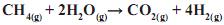
Em relação a este processo, é CORRETO afrmar que, ao reagir

Com base nesses dados, calcula-se que a massa, em gramas, de gás carbônico liberado para o ar pela reação foi igual a
Se, em repouso, uma pessoa consome 0,34 L de oxigênio por minuto, então o aumento da temperatura do ar resultará em massa menor de oxigênio consumido por minuto pela pessoa, o que explica o fato de ser mais difícil se respirar em dias muito quentes.
Considere que o volume residual de ar nos pulmões após uma expiração seja de 1,5 L. Nesse caso, se, em uma aspiração típica, forem absorvidos 0,5 L de ar e os pulmões permanecerem à temperatura constante, então a pressão exercida pelo ar após uma aspiração será equivalente a 75% da pressão nos pulmões com volume residual.
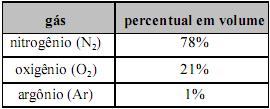
Considere que o ar atmosférico seja uma mistura de gases e tenha a composição mostrada na tabela abaixo. Sabendo-se que a massa molar aparente desse ar é a média ponderada que relaciona a fração em volume de cada componente com a sua respectiva massa molar e assumindo-se a constante universal dos gases R = 0,082 atm·L/KAmol, é correto afirmar que, a 1 atm e a 0 ºC, a densidade aparente desse ar é superior a 1,25 g/L.
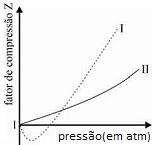
Considere que os gases da natureza, que são chamados de gases reais, tenham propriedades diferentes daquelas preditas pela lei dos gases ideais. Considere, ainda, o fator de compressão Z, que é a razão entre o volume molar do gás real e o volume molar de um gás ideal nas mesmas condições. Nesse caso, é correto afirmar que, no gráfico a seguir, da variação de Z em função da pressão, as curvas I e II representam, respectivamente, o comportamento dos gases NH3 e H2.
I.
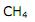
II.
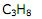
III.
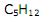
IV.
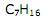
Assim, considerando-se 100,0g de uma amostra de gases ideais, que contém 64% de SO2, e 36% de He, em massa a 27°C, a 1,0atm, no interior de um recipiente, é correto afirmar:
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Os balões utilizados na prática de balonismo esportivo alçam vôo devido à queima de gás butano, que causa o aquecimento dos gases do interior do balão, fazendo com que esses gases se tornem menos densos que o ar.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Se o astrônomo utilizasse uma mistura de gases em seu balão, essa mistura poderia ser considerada como homogênea.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Sabendo-se que o astrônomo amador preencheu seu balão com uma quantidade de x gramas de gás hidrogênio, se o mesmo utilizasse 2x gramas desse gás no mesmo balão, este alcançaria uma altura muito maior antes de estourar.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O astrônomo amador poderia utilizar gases, como o hidrogênio, o hélio ou o nitrogênio, para encher e fazer voar o seu balão.
Em três recipientes de volumes iguais e à mesma temperatura são colocados, respectivamente, 2,6kg de etino, C2H2(g), 1,6kg de oxigênio, O2(g), e 2,3kg de dióxido de nitrogênio, NO2(g).
Considerando-se essas informações e admitindo-se que esses gases são ideais, é correto concluir:


