Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 237 questões
INSTRUÇÃO: Para responder à questão, analise o texto a seguir.
A energia eólica é a energia dos ventos, mas sua origem é a energia solar. Estima-se que 1 a 2% da energia solar converta-se em energia eólica. Isso porque a terra é aquecida pelo sol de forma irregular, gerando diferentes pressões atmosféricas em lugares distintos. O vento é o movimento do ar dos lugares com pressão mais alta para os de pressão mais baixa.
O aproveitamento da energia eólica em aerogeradores
é possível porque
“O ácido Sulfúrico é tido como um indicador da economia de um país, pois é o produto químico mais utilizado
pela indústria. Sua aplicação tem larga escala, desde em fertilizantes e baterias de automóveis, até
no refino do petróleo. É extremamente solúvel em água, porém, isto deve ser feito com muita cautela,
pois seus vapores são liberados agressivamente”.
Disponível em: <http://www.brasilescola.com/> .
Uma das maneiras de produzi-lo é através das reações com oxigênio, o qual ocupa uma fração de 21%, aproximadamente, no ar atmosférico. A partir das informações fornecidas e utilizando as reações não balanceadas apresentadas a seguir, referentes às etapas de produção de ácido sulfúrico, assinale a alternativa CORRETA.
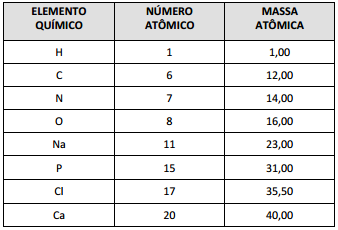
Dados: (Ma (g/mol): H = 1, O = 16, S= 32). Volume molar na CNTP: 22,71 L/mol, Avogadro = 6X1023
I) S8(s) + O2(g) → SO2(g)
II) SO2(g)+ O2(g) → SO3(g)
III) SO3(g) + H2O (l) → H2SO4 (aq)
Note e adote: Composição aproximada do ar em volume: 80% de N2 e 20% de O2.
O hélio é um gás monoatômico, incolor e inodoro,
que apresenta o menor ponto de evaporação de todos os
elementos químicos, e só pode ser solidificado sob
pressão elevada. Embora seja o segundo elemento
químico em abundância no universo, encontram-se, na
atmosfera terrestre, apenas traços provenientes da
desintegração de alguns de seus elementos. Em alguns
depósitos naturais de gás, é encontrado em quantidade
suficiente para a sua exploração. Estima-se que uma
reserva encontrada na Tanzânia contenha mais de 15
bilhões de metros cúbicos desse gás.
Considerando a densidade He = 0.18 kg/m³ , indique o número de átomos do gás hélio existente na reserva.
Dado: Volume de 1 mol de gás na CNTPé 22,4 L
A água oxigenada é o nome dado à solução comercial de peróxido de hidrogênio (H2 O2 ) em água. Em lojas de produtos químicos é possível adquirir frascos contendo água oxigenada 200 volumes. Essa concentração indica que a decomposição total do peróxido de hidrogênio contida em 1,0 L de solução produz 200 L de gás oxigênio medidos na CNTP.
A reação de decomposição da água oxigenada é representada pela equação química a seguir

Desse modo, 50 mL dessa solução contém,
aproximadamente,
Para o exercício, adote os seguintes valores quando necessário:

As unidades de concentração podem ser expressas de diferentes formas. Usualmente utilizamos a concentração comum e o título na maioria dos produtos alimentícios e farmacêuticos. Os cálculos químicos estequimétricos, porém, levam em consideração, preferencialmente, a molaridade.
A água oxigenada, por exemplo, tem sua concentração analisada por uma porcentagem ou pelo volume de oxigênio molecular produzido pela decomposição do peróxido de hidrogênio. Considere a análise de uma solução aquosa com 6 % em massa de peróxido de hidrogênio. A concentração aproximada dessa solução expressa em volume de gás oxigênio formado nas CNTP é de
- Volume molar nas CNPT = 22,4 L.
- Considere que 1 litro de água oxigenada libera 10 litros de gás oxigênio (O2), dessa forma, 10 litros de oxigênio é 10 vezes o volume de 1 litro de água oxigenada, por isso ela é chamada de 10 volumes.
- Considere também que a densidade da água oxigenada em questão é de 1 g.cm-3 .
Uma quantidade equivalente, em mol, de dois gases, nitrogênio e oxigênio, é colocada num recipiente rígido de 2,0 L.
Nesse sistema,
DADOS QUE PODEM SER USADOS NESTA PROVA
Uma amostra de 5 L de benzeno líquido, armazenada em um galpão fechado de 1500 m3 contendo ar atmosférico, evaporou completamente. Todo o vapor permaneceu no interior do galpão.
Técnicos realizaram uma inspeção no local, obedecendo às normas de segurança que indicam o tempo máximo de contato com os vapores tóxicos do benzeno.
Observe a tabela:
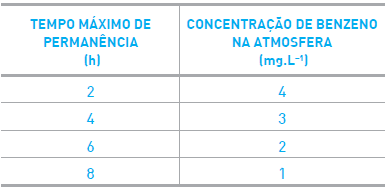
Considerando as normas de segurança, e que a densidade do benzeno líquido é igual a 0,9
g.mL-1, o tempo máximo, em horas, que os técnicos podem permanecer no interior do galpão,
corresponde a:
A bola utilizada em uma partida de futebol é uma esfera de diâmetro interno igual a 20 cm. Quando cheia, a bola apresenta, em seu interior, ar sob pressão de 1,0 atm e temperatura de 27 ºC.
Considere π = 3, R = 0,080 atm.L.mol-1 .k-1 e, para o ar, comportamento de gás ideal e massa molar igual a 30 g.mol-1.
No interior da bola cheia, a massa de ar, em gramas, corresponde a:
A pólvora é considerada a primeira mistura explosiva, usada na China, na Arábia e na Índia. Há textos chineses antigos que a denominam “substância química do fogo”, mesmo sendo uma mistura de nitrato de potássio, carvão e enxofre. A combustão da pólvora pode ser representada pela seguinte equação:
4KNO3 + 7C + S → 3CO2 + 3 CO + 2 N2 + K2CO3 + K2S
O que caracteriza a explosão é o súbito aumento de
volume, com grande liberação de energia. Nas CNTP,
520 g de pólvora produzem, por explosão,
Um veículo de passeio, movido a gasolina, deixou a capital paulista com o tanque cheio, dirigindo-se a uma cidade do interior situada a 480 km, na região noroeste do estado. Ao final da viagem, verificou-se que o consumo médio do veículo foi de 16 km por litro de combustível.
Admitindo-se que a composição média da gasolina seja dada pela fórmula C8 H18 e que a combustão seja completa, conclui-se que o volume de CO2 , em litros, medido nas CATP e lançado ao ar durante a viagem foi de, aproximadamente,
Dados
Volume molar de gás nas CATP = 25 L / mol
Densidade da gasolina = 8 x 102 g / L
Massas molares em g / mol:
C = 12; H = 1 e O = 16
Na figura, apresenta-se um biodigestor utilizado em áreas rurais. Ele é totalmente vedado, criando um ambiente anaeróbio onde os microrganismos degradam o material orgânico (dejetos e restos de ração), transformando-o em biogás. O gasômetro é o compartimento superior do biodigestor e serve para a armazenagem de gases. Ele é inflável e feito de uma manta de material plástico impermeável (PVC). No gasômetro, a pressão e a temperatura são constantemente iguais às da atmosfera.
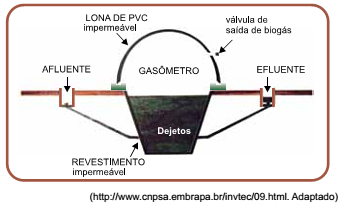
Considere uma quantidade fixa de gás no gasômetro descrito
no texto. A variação percentual do volume do gás contido
nesse compartimento ao longo de um dia, em que a temperatura
varia de mínima de 17 °C, durante a madrugada, para a
máxima de 38 °C, no decorrer do dia, é próxima de
TEXTO 5
NA VIRADA DO SÉCULO, o biólogo Roosmarc conheceu o ápice da fama ao descobrir um novo gênero de primata: o sagui-anão-de-coroa-preta. Foi considerado pela revista Time o grande herói do planeta. Entre os mais de 500 primatas no mundo, Roosmarc descobrira o Callibella humilis, o macaquinho mais saltitante e alegre, anãozinho, com aquela coroa preta. Enquanto outros primatólogos matavam os animais para descrevê-los, dissecando-os em laboratórios, longe da Amazônia, ele criava macacos em sua casa. Esperava que morressem de forma natural e, aí sim, dissecava-os.
O sagui-anão-de-coroa-preta foi a sensação mundial. Então, ele viveu o ápice da glória. As publicações científicas não se cansaram de elogiá-lo. Quase todos os dias, jornais e revistas estampavam: “Protetor dos animais”, “O bandeirantes da Amazônia”, “O último primatólogo”. De Manaus para o mundo. Os ribeirinhos o saudavam; os políticos o pajeavam; os estudantes de biologia o veneravam. Sim, Roosmarc era visto e considerado como herói do planeta.
Vida simples, com suas vestes quase sempre largas cobrindo o corpo magro e alto, enfiado semanas na floresta, nunca quisera dinheiro, jamais almejara fortuna. O verdadeiro cientista, dizia, quer, antes de tudo, reconhecimento. Não havia prêmio maior do que isso. Sequer gastava o que ganhava. Aprendera com os bichos que, na vida, não se precisa de muitas coisas...
Nascera no sul da Holanda e, aos 17 anos, mudou-se para Amsterdã. Queria estudar biologia. Nos fins do ano 60, a cidade fervilhava, era a capital da contestação. John Lennon e Yoko Ono haviam escolhido a cidade para protestar contra a Guerra do Vietnã. Os rebeldes desfilavam pelas ruas, enquanto John Lennon e Yoko Ono incitavam a quebra de valores deitados uma semana num hotel da cidade, consumindo droga e criando suas canções. O gosto pela contracultura crescia, agigantava-se. Rebelde, Roosmarc desfilava pelas ruas, gritando pela paz, também queimando maconha e outras ervas.
Mas foi, nesta época, que ele se interessou pelos primatas. Depois que terminou a universidade, fez amizade com uma estudante, que também saboreava a contracultura, o desprezo a normas e procedimentos, e com ela, vivendo um romance apaixonado, deu volta ao mundo, como se fosse o famigerado navegante português Vasco da Gama. Estudante de artes plásticas, Marie tinha sede por aventuras: o novo lhe apetecia; o velho não era mais do que um mundo cinzento. A Europa, com seus prédios cinzentos e frios, uma população resignada, não lhe apetecia. Queria quebrar barreiras, outras fronteiras. Não queria apodrecer naquelas cidadezinhas holandesas, onde as mulheres envelheciam rapidamente e só cuidavam de casa. Não queria se transformar num símbolo de cama, fogão e igreja. Menosprezava o título “rainha do lar”, que os pastores tanto veneravam entre a população fiel. Tinha horror ao ver sua mãe de lenço na cabeça e avental cobrindo a gordura da barriga. Se ficasse numa daquelas cidadezinhas, em poucos anos estaria como a mãe – brigava constantemente com o seu pai, saía de casa aos domingos para assistir a mesmice do partor Simeão, e que, rapidamente, voltava para casa para preparar o almoço para os filhos. Que destino! A liberdade a chamava. Não era o que dizia a canção de John Lennon? Ao conhecer Roosmarc, o desejo por aventuras avivou como brasa viva. Quando convidada para segui-lo, e ela queria produzir desenhos e aquarelas jamais vistas no mundo, não titubeou, como se a oportunidade fosse um cavalo encilhado. E cavalo encilhado passa por nós somente uma vez ...
(GONÇALVES, David. Sangue verde. Joinville: Sucesso Pocket, 2014. p. 200-201.Adaptado.)
Analise as afirmativas a seguir:
I- Se dentro do botijão for armazenado um gás perfeito, o volume ocupado pelas suas moléculas e as interações entre elas serão desprezíveis.
II-Pela lei da conservação das massas, a queima de 13 kg de gás de cozinha irá produzir 13 kg de produtos da reação.
III-Em um botijão contendo 31,5 L de um gás perfeito, submetido à pressão de 1 atm e temperatura de 0ºC, haverá aproximadamente 8,5 x 1023 moléculas do referido gás. Dados: número de Avogadro 6,022 x 1023; volume molar 22,4 L/mol.
IV- Supondo-se que um botijão de gás cheio, com 13 kg de uma mistura em estado gasoso composta por 55% de butano e 45% de propano, a pressão parcial desses gases é, respectivamente, de 97 atm e 104 atm. Dados: R = 0,082 atm.L/mol.K; T = 273,15K; V = 31,5 L.
Em relação às proposições analisadas, assinale a única alternativa cujos itens estão todos corretos:

