Questões de Vestibular
Sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 230 questões
DADOS QUE PODERÃO SER UTILIZADOS
NA QUESTÃO DE QUÍMICA

Constante Universal dos Gases
Perfeitos: 0,082 atm.L/mol.K
Ao chegar ao Rio, de Corumbá, Fuentes hospedou-se no Hotel Bragança, na avenida Mem de Sá. Um hotel cheio de turistas argentinos falando portunhol. [...] Na lista telefônica Fuentes escolheu um oftalmologista de nome espanhol, Pablo Hernandez. O dr. Hernandez descendia de uruguaios e, para desapontamento de Fuentes, não falava espanhol. Em seu bem montado consultório, na avenida Graça Aranha, na Esplanada do Castelo, examinou Fuentes cuidadosamente. O cristalino, a íris, a conjuntiva, o nervo ótico, os músculos, artérias e veias do aparelho ocular estavam perfeitos. A córnea, porém, fora atingida. Didaticamente Hernandez explicou ao seu cliente que a córnea era uma camada externa transparente através da qual a luz – e com a luz, a cor, a forma, o movimento das coisas – penetrava no olho.
Córnea – moça, 24ª , vende. Tel. 185-3944. O anúncio no O Dia foi lido por Fuentes. Ele ligou de seu quarto, no Hotel Bragança. Atendeu uma mulher...[...] Ela disse que ele podia pegar um ônibus no largo de São Francisco. “É para você?”, perguntou a mulher quando Fuentes lhe falou que era a pessoa que havia telefonado. [...] “Sim, é para mim.” A mulher não ter percebido a cicatriz no seu olho esquerdo deixou Fuentes satisfeito. [...] “Dez milhas”, disse a mulher impaciente. “E não é caro. O preço de um carro pequeno. Minha filha é muito moça, nunca teve doença, dentes bons, ouvidos ótimos. Olhos maravilhosos.”
(FONSECA, Rubem. A Grande Arte. São Paulo: Companhia das Letras, 2008. p. 137-139.)
Com base em algumas ideias do texto 02, foram elaboradas as proposições abaixo. Marque a única correta:
A bola utilizada em uma partida de futebol é uma esfera de diâmetro interno igual a 20 cm. Quando cheia, a bola apresenta, em seu interior, ar sob pressão de 1,0 atm e temperatura de 27 ºC.
Considere π = 3, R = 0,080 atm.L.mol-1 .k-1 e, para o ar, comportamento de gás ideal e massa molar igual a 30 g.mol-1.
No interior da bola cheia, a massa de ar, em gramas, corresponde a:
Um veículo de passeio, movido a gasolina, deixou a capital paulista com o tanque cheio, dirigindo-se a uma cidade do interior situada a 480 km, na região noroeste do estado. Ao final da viagem, verificou-se que o consumo médio do veículo foi de 16 km por litro de combustível.
Admitindo-se que a composição média da gasolina seja dada pela fórmula C8 H18 e que a combustão seja completa, conclui-se que o volume de CO2 , em litros, medido nas CATP e lançado ao ar durante a viagem foi de, aproximadamente,
Dados
Volume molar de gás nas CATP = 25 L / mol
Densidade da gasolina = 8 x 102 g / L
Massas molares em g / mol:
C = 12; H = 1 e O = 16
I. Gases são facilmente compressíveis, preenchem o espaço disponível e suas moléculas possuem movimento caótico incessante.
II. A energia cinética média das moléculas de um gás é diretamente proporcional à temperatura absoluta.
III. A pressão de um gás é o resultado das colisões das moléculas com as paredes do recipiente.
IV. As moléculas se movimentam sem colidirem com as paredes do recipiente que as contém.
Assinale a alternativa que apresenta informações corretas.
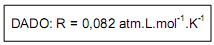




A partir dessas informações, julgue o itens de 58 a 66, assinale
a opção correta no item 67 e faça o que se pede no item 68, que
é do tipo B.

Com a decomposição de 400kg de calcário, se emitem para a atmosfera
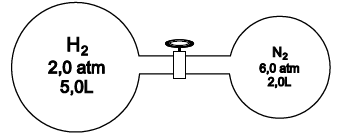
A figura representa um sistema formado por dois recipientes interligados por uma válvula fechada, a determinada temperatura, contendo, respectivamente, os gases ideais, hélio e nitrogênio, nas condições apresentadas.
A partir da abertura da válvula, a essa temperatura, é correto afirmar:

Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de
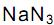 , o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
, o volume de nitrogênio gasoso que se obtém é, aproximadamente, de 

Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de
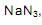 o volume de nitrogênio gasoso que se obtém é, aproximadamente,
o volume de nitrogênio gasoso que se obtém é, aproximadamente,de


Considere que o volume de um mol de gás, nas CNTP, corresponda a 22,4 litros. Nessas condições, de acordo com a equação química, quando reagem 3 moles de
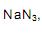 o volume de nitrogênio gasoso que se obtém é, aproximadamente, de
o volume de nitrogênio gasoso que se obtém é, aproximadamente, de Considere: R = 0,082L . atm . k-1 . mol-1
