Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 879 questões
1. Adição de 20 mL de água a uma solução aquosa saturada em cloreto de sódio, contendo um grande excesso de sal sedimentado, tal que ainda permaneça precipitado após a adição de mais solvente. 2. Adição de 20 mL de água a uma solução aquosa não saturada em cloreto de sódio. 3. Retirada de fenol, solúvel em água e em éter etílico, de uma solução aquosa, por agitação com uma porção de éter etílico seguida por separação da fase orgânica da fase aquosa. 4. Dissolver glicose em água e a esta solução juntar etanol para que surjam novamente cristais de glicose. 5. Adição de 20 mL de água a nitrato de potássio cristalino.
a) Dissolução b) Extração c) Diluição d) Recristalização
Na reação de óxi-redução

as variações dos números de oxidação do enxofre e do
iodo são, respectivamente,
MX (s) ↠ M+(g) + X-(g)
Considere os seguintes compostos: NaF, NaCl, CaF2, CaCl2‚, LiF e LiCl. Com base nas informações, assinale a alternativa correta.
Amostra I: É um gás incolor que liquefaz a uma temperatura de -183° C. Quando submetido a processos usuais de decomposição, permanece a mesma substância. Amostra II: É um sólido branco que apresenta ponto de fusão igual a 800°C e ponto de ebulição igual a 1413°C. Quando submetido à decomposição por eletrólise, origina um sólido metálico e libera um gás. Amostra III: É um líquido límpido e incolor que não mantém uma temperatura constante durante sua ebulição. Após a destilação observa-se a formação de cristais brancos no fundo do recipiente que o contém.
As amostras I, II e III podem ser, respectivamente,
1. ponto de ebulição 2. Massa 3. Volume 4. densidade
Assinale as propriedades que podem permitir ao estudante a identificação desses líquidos.
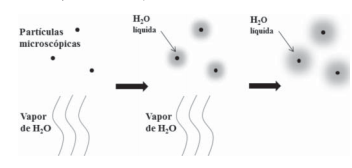
A formação de nuvens, considerando o processo descrito acima, é possível porque o vapor de água, de menor __X__ que o ar atmosférico, chega até a parte mais alta da atmosfera onde entra em contrato com partículas microscópicas mais __Y__ e sofre o processo de __Z__.
No trecho anterior, X, Y e Z podem ser substituídos, respectivamente, por:
O diamante é reconhecido mundialmente por sua rara beleza e brilho ofuscante. A lapidação do cristal tem por objetivo realçar o brilho, criando facetas com ângulos e dimensões que permitem que a luz recebida pela parte superior do cristal, por exemplo, seja refletida em seu interior e saia principalmente pela parte superior. Desta forma, há o máximo de cintilação e de espalhamento da luz.
Um joalheiro bastante experiente lapidou um pedaço de vidro e um diamante do mesmo tamanho, cortandoos em inúmeras facetas e, a seguir, os poliu de forma a ficarem idênticos. Contudo, o vidro não apresenta o mesmo brilho do diamante ao ser incidido pela luz.
Fonte: SOUZA, Líria Alves de. "Brilho do diamante"; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/brilho-diamante.htm>. Acesso em 20 de maio de 2018. (adaptado)
O vidro, mesmo após todo esse processo, não exibe o mesmo brilho pois o diamante é um sólido
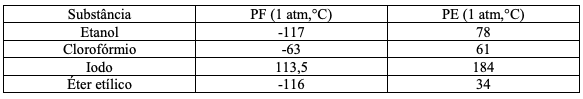
Analisando os dados da tabela e considerando 28° C e 1 atm, pode-se afirmar que o estado físico de cada substância é, respectivamente:
ASSINALE o tipo de sistema produzido pelos componentes água e álcool e a forma de transmissão do calor do sol para esse sistema:
A seguir estão representadas quatro estruturas de substâncias.
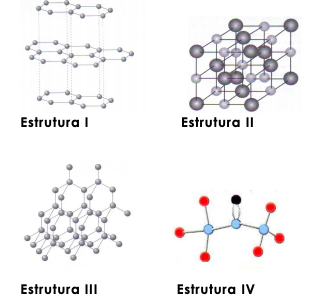
Considerando-se essas estruturas, é correto afirmar:
Ocorre um processo químico, por exemplo, quando